YOD1: La Proteina Guardiana che Blocca il Tumore al Rene Stabilizzando ZNF24
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nel campo della ricerca oncologica, in particolare per un tipo di tumore al rene chiamato carcinoma renale a cellule chiare (ccRCC). Sapete, una delle sfide più grandi quando si combatte il cancro è la sua capacità di diffondersi, di creare metastasi. E nel caso del ccRCC, questo è un problema serissimo. Nonostante i progressi, le metastasi rendono questo tumore particolarmente aggressivo, con tassi di sopravvivenza a cinque anni ancora troppo bassi. Ecco perché è fondamentale scavare a fondo nei meccanismi molecolari che guidano questa diffusione.
Alla ricerca di nuovi bersagli: il mondo delle deubiquitinasi
Nel nostro corpo, c’è un sistema incredibilmente complesso che regola la vita e la morte delle proteine: il sistema ubiquitina-proteasoma (UPS). Immaginatelo come un ufficio di smistamento: alcune proteine vengono “etichettate” con una molecola chiamata ubiquitina, segnale che le destina alla distruzione nel proteasoma. Questo processo è vitale per mantenere l’equilibrio cellulare. Ma cosa succede se questo sistema si inceppa? Nel ccRCC, ad esempio, mutazioni nel gene VHL impediscono la corretta degradazione di proteine come HIF-α, che finiscono per promuovere la crescita del tumore e la formazione di nuovi vasi sanguigni (angiogenesi).
Recentemente, l’attenzione si è spostata su degli “operatori” specifici di questo sistema: le enzimi deubiquitinasi (DUBs). Questi enzimi fanno il lavoro opposto: rimuovono le etichette di ubiquitina, salvando le proteine dalla distruzione. Se le DUBs non funzionano correttamente, possono contribuire allo sviluppo del cancro. Tra le varie famiglie di DUBs, quella chiamata OTU è particolarmente interessante. Alcuni membri di questa famiglia sono già stati collegati al cancro, ma molti rimangono ancora un mistero.
La scoperta: YOD1 entra in scena
Per capire quali DUBs della famiglia OTU potessero essere coinvolte nella metastasi del ccRCC, abbiamo fatto uno screening un po’ “alla cieca”, spegnendo (tecnicamente si dice “knockdown”) uno per uno questi enzimi in cellule tumorali e osservando cosa succedeva. E qui è arrivata la sorpresa: quando abbiamo spento un enzima chiamato YOD1, le cellule tumorali hanno iniziato a muoversi e a migrare molto più velocemente, circa il doppio rispetto al normale!
Questo ci ha fatto drizzare le antenne. Siamo andati a vedere i dati disponibili su pazienti con ccRCC (dal database TCGA) e abbiamo scoperto che, in effetti, i livelli di YOD1 erano significativamente più bassi nei tessuti tumorali rispetto a quelli sani. Non solo: livelli bassi di YOD1 erano associati a stadi più avanzati del tumore, a gradi istologici peggiori e, cosa più importante, a una sopravvivenza generale e libera da malattia significativamente ridotta per i pazienti. Era chiaro: YOD1 sembrava giocare un ruolo da “soppressore tumorale”.
YOD1 frena la crescita e la diffusione del tumore
Per confermare i nostri sospetti, abbiamo condotto una serie di esperimenti sia in vitro (in laboratorio, su cellule e organoidi) che in vivo (su modelli animali).
- In vitro: Spegnendo YOD1 nelle cellule di ccRCC, abbiamo visto un aumento della loro proliferazione (si moltiplicavano di più), della loro capacità di formare colonie, e della loro abilità di migrare e invadere tessuti circostanti. Al contrario, aumentando i livelli di YOD1, questi processi venivano inibiti. Un risultato particolarmente interessante è arrivato dagli organoidi tumorali derivati direttamente da pazienti: anche in questi “mini-tumori” coltivati in laboratorio, spegnere YOD1 ne accelerava significativamente la crescita.
- In vivo: Abbiamo iniettato cellule di ccRCC con YOD1 spento in topi. Risultato? I tumori crescevano molto più rapidamente e, cosa ancora più preoccupante, si formavano molte più metastasi nei polmoni rispetto ai topi con cellule di controllo.
Tutti questi dati puntavano nella stessa direzione: YOD1 agisce come un freno, sopprimendo la crescita e la capacità metastatica del carcinoma renale a cellule chiare. Ma come fa esattamente?
Il partner chiave: ZNF24
Essendo YOD1 una deubiquitinasi, la nostra ipotesi era che agisse rimuovendo l’ubiquitina da qualche altra proteina, stabilizzandola e permettendole così di svolgere la sua funzione. Ma quale proteina? Per scoprirlo, abbiamo “pescato” le proteine che interagivano con YOD1 nelle cellule. E tra le candidate più promettenti è emersa una proteina chiamata ZNF24 (Zinc finger protein 24).
ZNF24 era già nota per essere un repressore trascrizionale, cioè una proteina capace di “spegnere” l’espressione di altri geni. In particolare, si sapeva che ZNF24 può bloccare la produzione di VEGFA, una molecola fondamentale per l’angiogenesi, quel processo che permette al tumore di crearsi nuovi vasi sanguigni per nutrirsi e crescere. Guarda caso, anche ZNF24 risultava essere meno espressa nel ccRCC e bassi livelli correlavano con una prognosi peggiore. Poteva essere lei la chiave?
Abbiamo verificato: esperimenti di co-immunoprecipitazione (una tecnica per vedere se due proteine si legano) hanno confermato che YOD1 e ZNF24 interagiscono fisicamente dentro le cellule. Addirittura, usando proteine purificate in laboratorio, abbiamo dimostrato che l’interazione è diretta. Studiando le strutture delle due proteine, abbiamo anche capito quali parti specifiche si legano: il dominio UBX-like di YOD1 si lega al dominio SCAN box di ZNF24.
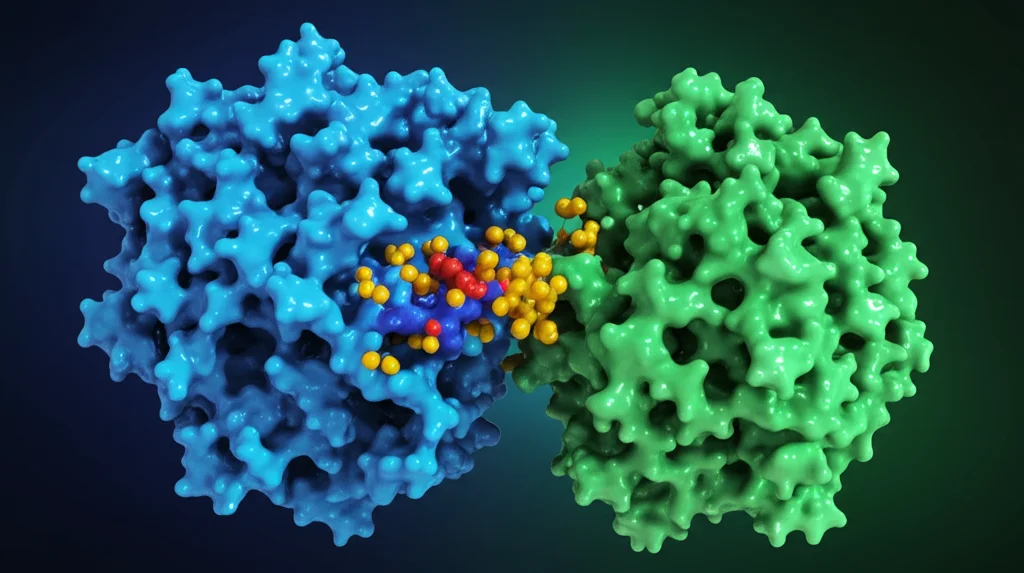
Il meccanismo svelato: YOD1 salva ZNF24 dalla distruzione
Ora veniva il bello: YOD1 deubiquitina ZNF24? La risposta è sì! Aumentando YOD1 nelle cellule, i livelli di ubiquitina attaccati a ZNF24 diminuivano drasticamente. Questo effetto dipendeva proprio dall’attività enzimatica di YOD1: una versione mutata di YOD1, incapace di rimuovere l’ubiquitina (YOD1-C160S), non aveva alcun effetto. Al contrario, spegnendo YOD1, ZNF24 diventava molto più ubiquitinata.
Abbiamo anche scoperto che tipo di catene di ubiquitina YOD1 rimuoveva da ZNF24: specificamente quelle legate ai residui di lisina K27, K29 e K48, spesso segnali per la degradazione tramite il proteasoma. E siamo riusciti a identificare persino il sito preciso su ZNF24 dove avviene l’ubiquitinazione cruciale (e quindi la deubiquitinazione da parte di YOD1): la lisina in posizione 308 (K308).
Cosa significa tutto questo? Significa che YOD1 protegge ZNF24 dalla degradazione. Quando YOD1 è presente e attivo, rimuove le etichette di ubiquitina da ZNF24, rendendola più stabile e quindi più abbondante nella cellula. Lo abbiamo confermato misurando la “vita media” della proteina ZNF24: con più YOD1, ZNF24 durava molto più a lungo; spegnendo YOD1, ZNF24 veniva degradata molto più velocemente. E questa degradazione dipendeva proprio dal proteasoma.
L’asse YOD1/ZNF24/VEGFA: un trio cruciale
A questo punto, il puzzle iniziava a comporsi. Abbiamo messo insieme i pezzi:
- YOD1 normalmente stabilizza ZNF24 deubiquitinandola.
- ZNF24 stabile può svolgere la sua funzione di repressore trascrizionale, tenendo a bada l’espressione di VEGFA.
- Meno VEGFA significa meno angiogenesi, meno nutrimento per il tumore, e quindi meno crescita e metastasi.
Nel ccRCC, però, spesso YOD1 è poco espresso. Questo porta a una minore stabilità di ZNF24, che viene degradata più facilmente. Con meno ZNF24 in giro, la repressione su VEGFA si allenta, VEGFA aumenta, l’angiogenesi viene stimolata e il tumore può crescere e diffondersi più facilmente.
Abbiamo testato questa ipotesi: in cellule dove avevamo spento YOD1 (causando aumento di crescita, migrazione e VEGFA), se contemporaneamente aumentavamo artificialmente i livelli di ZNF24, riuscivamo a invertire questi effetti negativi! La crescita rallentava, la migrazione diminuiva e i livelli di VEGFA tornavano a scendere. Esperimenti specifici (ChIP assay) hanno confermato che YOD1, tramite ZNF24, regola quanto ZNF24 si lega al promotore del gene VEGFA per bloccarne la trascrizione. Abbiamo anche visto che il “succo” (mezzo condizionato) proveniente da cellule con YOD1 spento stimolava la formazione di strutture simili a vasi sanguigni (tube formation assay) da parte di cellule endoteliali (HUVEC), ma questo effetto veniva annullato se si aumentava ZNF24.
Anche negli esperimenti sui topi, aumentare ZNF24 nelle cellule con YOD1 spento riusciva a contrastare l’aumento della crescita tumorale e delle metastasi polmonari indotto dalla mancanza di YOD1.
Implicazioni cliniche e prospettive future
Per dare ancora più peso a questi risultati, siamo tornati ad analizzare campioni di tessuto tumorale da pazienti con ccRCC. Usando tecniche come il Western Blotting e l’immunoistochimica (IHC) su due coorti di pazienti, abbiamo confermato che i livelli di proteina YOD1 e ZNF24 erano effettivamente più bassi nei tumori rispetto ai tessuti normali. E, cosa fondamentale, abbiamo trovato una forte correlazione positiva tra i livelli di YOD1 e quelli di ZNF24: dove c’era poco YOD1, c’era anche poco ZNF24.
Dal punto di vista prognostico, i pazienti con bassi livelli sia di YOD1 che di ZNF24 avevano una sopravvivenza significativamente peggiore. Questo suggerisce che misurare i livelli di queste due proteine potrebbe aiutare a predire l’aggressività del tumore e l’esito per il paziente.
In sintesi, il nostro lavoro ha svelato per la prima volta questo meccanismo: YOD1 agisce come un soppressore tumorale nel ccRCC stabilizzando la proteina ZNF24 attraverso la deubiquitinazione. ZNF24, a sua volta, reprime VEGFA, bloccando così l’angiogenesi e frenando la crescita e la metastasi del tumore.
Questa scoperta apre nuove strade. L’asse YOD1/ZNF24/VEGFA potrebbe rappresentare un nuovo bersaglio terapeutico. Magari si potrebbero sviluppare farmaci che potenziano l’attività di YOD1 o che mimano la sua azione stabilizzante su ZNF24, oppure strategie per ripristinare i livelli di ZNF24 nelle cellule tumorali. Certo, la strada è ancora lunga, e ci sono aspetti da approfondire (ad esempio, studiare meglio il ruolo di YOD1 negli organoidi derivati da metastasi e la sua dipendenza dall’attività enzimatica in quel contesto), ma aver identificato questo meccanismo è un passo avanti importante nella comprensione e, speriamo, nel futuro trattamento del carcinoma renale a cellule chiare.
Fonte: Springer