YLID: Il Cristallo Più Banale del Mondo? Preparatevi a Ricredervi!
Ciao a tutti! Oggi voglio raccontarvi una storia che ha dell’incredibile e che riguarda qualcosa che, forse senza saperlo, moltissimi laboratori di chimica e fisica nel mondo hanno sotto mano: un piccolo cristallo giallo chiamato YLID (2-dimetilsulfuranilidene-1,3-indandione). Perché è così famoso? Non per le sue proprietà strabilianti, ma perché da oltre 50 anni è il “cristallo di prova” standard usato da quasi tutti i produttori di diffrattometri a raggi X per calibrare i loro strumenti. Una sorta di “metro campione” per chi studia le strutture atomiche.
Potreste pensare: “Ok, un cristallo standard, che noia!”. E invece no! Proprio perché dato per scontato, nessuno si era mai soffermato a studiarlo davvero a fondo con le tecniche più moderne. Ed è qui che entro in gioco io (o meglio, noi ricercatori) con la cristallografia quantistica. Abbiamo deciso di usare YLID come esempio per mostrare come queste nuove metodologie possano svelare storie nascoste anche negli oggetti più comuni, riportando l’attenzione sulle sue interessantissime proprietà chimiche e fisiche.
Un Mondo Nascosto nella Struttura più Comune
Pensateci: decine di migliaia di strutture di YLID determinate in mezzo secolo in ogni angolo del pianeta. Eppure, pochissimi studi pubblicati e solo una manciata di dati sperimentali disponibili. Sembrava quasi che la sua “banalità” lo avesse reso invisibile agli occhi della scienza più curiosa.
Ma cosa succede se smettiamo di guardarlo come un semplice standard e iniziamo a interrogarlo con strumenti più potenti? Abbiamo applicato un protocollo di cristallografia quantistica (QCr). Cos’è? In parole povere, è un approccio che va oltre il modello standard (chiamato IAM, Independent Atom Model) in cui gli atomi sono visti come sferette isolate. La QCr li considera per quello che sono: entità non sferiche che obbediscono alle leggi della meccanica quantistica, permettendoci di “vedere” i legami chimici, le densità elettroniche e persino ricostruire le funzioni d’onda direttamente dall’esperimento di diffrazione.
In particolare, abbiamo usato una tecnica chiamata Hirshfeld Atom Refinement (HAR). Immaginatela come una versione “potenziata” dell’analisi cristallografica standard, che usa fattori di forma atomici molto più realistici, derivati da calcoli quantistici. Questo ci permette di ottenere geometrie molecolari incredibilmente accurate, specialmente per gli atomi di idrogeno (che sono notoriamente difficili da “vedere” bene con i raggi X standard), e di studiare la distribuzione degli elettroni nella molecola.

La Sorpresa della Chiralità e Nuove Forme
Una delle prime scoperte sorprendenti riguarda la chiralità. La molecola di YLID in sé non è chirale (non ha un centro stereogenico, come la vostra mano destra e sinistra), ma quando si impacchetta nel cristallo della forma più comune (ortorombica), lo fa seguendo un asse elicoidale. Questo impacchettamento elicoidale rende l’intero cristallo chirale! Finora, in letteratura era descritta solo la forma con elicità destrorsa (che chiamiamo RS). Noi abbiamo trovato e caratterizzato anche la forma sinistrorsa (LS)!
La cosa buffa? La maggior parte dei possessori di questi cristalli test non ha idea della chiralità del proprio campione, perché non viene specificato dai produttori. Usando HAR, siamo riusciti a determinare in modo affidabile la chiralità (tramite il parametro di Flack) anche con diverse lunghezze d’onda dei raggi X, dimostrando la potenza di questi metodi.
Ma non è finita qui. La molecola di YLID nella forma ortorombica è “storta”, piegata rispetto al piano principale della molecola. Esiste però un’altra forma cristallina (monoclina) in cui la molecola è perfettamente planare. Ci siamo chiesti: cosa serve per far passare la molecola dalla forma storta a quella planare?
Esperimenti sotto Pressione: Fisica e Chimica
Abbiamo provato di tutto:
- Temperatura: Abbiamo analizzato dati a diverse temperature (da 100 K, cioè -173°C, a temperatura ambiente), ma niente, la forma ortorombica (storta) rimane stabile.
- Pressione Esterna: Abbiamo messo il cristallo ortorombico in una cella a incudine di diamante e applicato pressioni pazzesche, fino a 4 GPa (circa 40.000 volte la pressione atmosferica!). Il cristallo si comprime notevolmente (il volume si riduce del 19%!), gli spazi vuoti al suo interno quasi scompaiono, ma la molecola rimane ostinatamente storta. Nessuna transizione alla forma planare.
E poi, l’idea: la pressione chimica. Cosa succede se invece di schiacciare il cristallo meccanicamente, proviamo a “infiltrarlo” con altre molecole? Abbiamo lasciato un cristallo ortorombico a bagno in olio minerale umido per mesi. Risultato? Una trasformazione da cristallo singolo a cristallo singolo! Il cristallo ha incorporato due molecole d’acqua nella sua struttura, cambiando completamente impacchettamento. La nuova struttura (un co-cristallo con acqua) è diventata monoclinica, non chirale, e – finalmente! – le molecole di YLID al suo interno sono diventate planari. Sembra che i legami idrogeno con l’acqua siano riusciti dove la pressione fisica aveva fallito, rompendo la struttura elicoidale e favorendo la planarità. Questo dimostra anche che il “roccioso” cristallo test non è poi così stabile come si pensava!
Dentro il Legame Chimico e Oltre
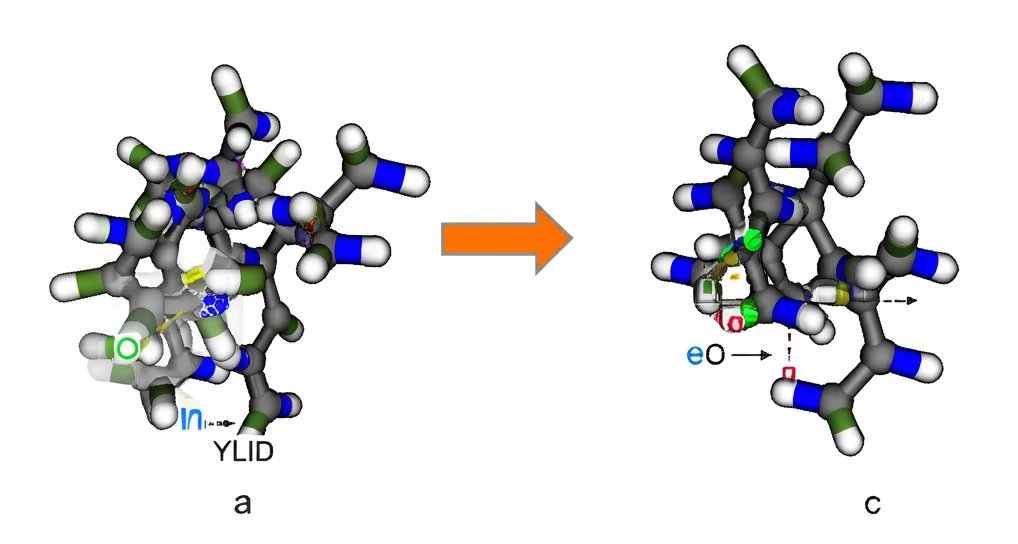
Grazie alla cristallografia quantistica (in particolare con una tecnica chiamata X-ray Wavefunction Refinement, XWR, che ci permette di ottenere la matrice densità sperimentale), abbiamo potuto analizzare in dettaglio il legame chiave S-C (zolfo-carbonio) nella molecola di YLID. Questo legame è particolare (ilidico) e può essere descritto da diverse forme di risonanza. La nostra analisi della densità elettronica conferma che la forma più importante è quella con una separazione di carica (S+ – C-), con una coppia solitaria di elettroni sul carbonio, anche se questa è “spalmata” a causa della risonanza con i gruppi carbonilici vicini. Abbiamo anche quantificato il carattere ionico e covalente del legame.
Un altro aspetto affascinante emerso è legato ai coefficienti di dispersione anomala (f’ e f”). Sono parametri che correggono come ogni atomo interagisce con i raggi X e dipendono dalla lunghezza d’onda. Di solito si usano valori tabulati calcolati per atomi isolati. Noi, per la prima volta su misure ripetute dello stesso composto, li abbiamo raffinati direttamente durante l’analisi HAR per l’atomo di zolfo. Risultato? I valori ottenuti sperimentalmente sono significativamente diversi da quelli tabulati! In particolare, f’ è più piccolo e f” è più grande. Questo suggerisce fortemente che l’intorno chimico, cioè come un atomo è legato ai suoi vicini, influenzi questi parametri. È un’indicazione importante che i modelli quantistici sono necessari per descrivere accuratamente anche questi effetti.

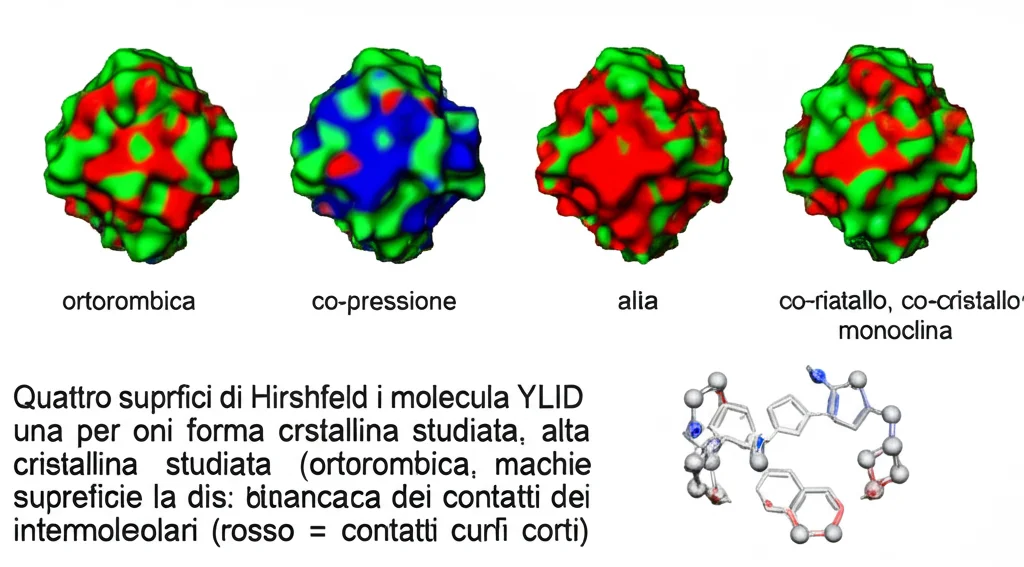
Interazioni Visibili: Le Superfici di Hirshfeld
Per capire come le molecole interagiscono tra loro nei diversi cristalli, abbiamo usato l’analisi delle superfici di Hirshfeld e i relativi fingerprint plot. Sono strumenti grafici che mostrano i contatti intermolecolari. Le immagini (vedi figura nell’articolo originale) mostrano chiaramente come l’ambiente attorno a una molecola di YLID sia completamente diverso nelle quattro situazioni studiate (ortorombica, ortorombica ad alta pressione, co-cristallo con acqua, monoclina).
Ad esempio:
- Nella forma ortorombica, dominano interazioni C-H…O e C-H…π (con gli anelli aromatici).
- Ad alta pressione, i contatti H…H diventano preponderanti perché le molecole sono schiacciate l’una contro l’altra.
- Nel co-cristallo con acqua, i legami idrogeno O-H…O con l’acqua diventano importantissimi (33% dei contatti), e compaiono anche interazioni π-π stacking tra gli anelli.
- Nella forma monoclina (planare, senza acqua), le interazioni sono ancora diverse.
Questo evidenzia come l’impacchettamento cristallino sia un delicato equilibrio di forze che influenza, e viene influenzato da, la forma stessa della molecola.
Lezioni da un Cristallo (Non Così) Comune
Cosa ci insegna tutta questa storia? Che anche la struttura cristallina più studiata e “scontata” del mondo può nascondere sorprese incredibili se la si guarda con occhi nuovi e strumenti più potenti come quelli della cristallografia quantistica. HAR e XWR ci hanno fornito geometrie precisissime, dettagli sul legame chimico e sulla chiralità.
Abbiamo scoperto una nuova forma chirale (LS), esplorato la complessa relazione tra impacchettamento elicoidale e chiralità molecolare planare, e capito che né la temperatura né la pressione esterna riescono a far “appiattire” la molecola YLID nella sua forma ortorombica. Solo la “pressione chimica”, l’inserimento di molecole d’acqua, riesce a indurre la trasformazione alla forma planare, modificando completamente le interazioni intermolecolari. Abbiamo anche ottenuto indizi sul fatto che i parametri di dispersione anomala dipendono dall’intorno chimico dell’atomo.
Questo lavoro su YLID è un invito a non dare mai nulla per scontato in scienza e a rivisitare composti fondamentali con le lenti potenti della cristallografia quantistica. Chissà quante altre storie affascinanti aspettano solo di essere scoperte nei cassetti dei nostri laboratori!
Fonte: Springer