Leucemia Linfatica Cronica: Vi Svelo Come Wnt5a e ROR1 Giocano a Nascondino per Potenziare l’Invasività!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico della Leucemia Linfatica Cronica (LLC). So che può sembrare un argomento complesso, ma fidatevi, cercherò di renderlo il più chiaro e intrigante possibile. Parleremo di come queste cellule tumorali diventano così “brave” a muoversi e infiltrarsi nel nostro corpo, un aspetto cruciale che purtroppo si lega a forme più aggressive della malattia.
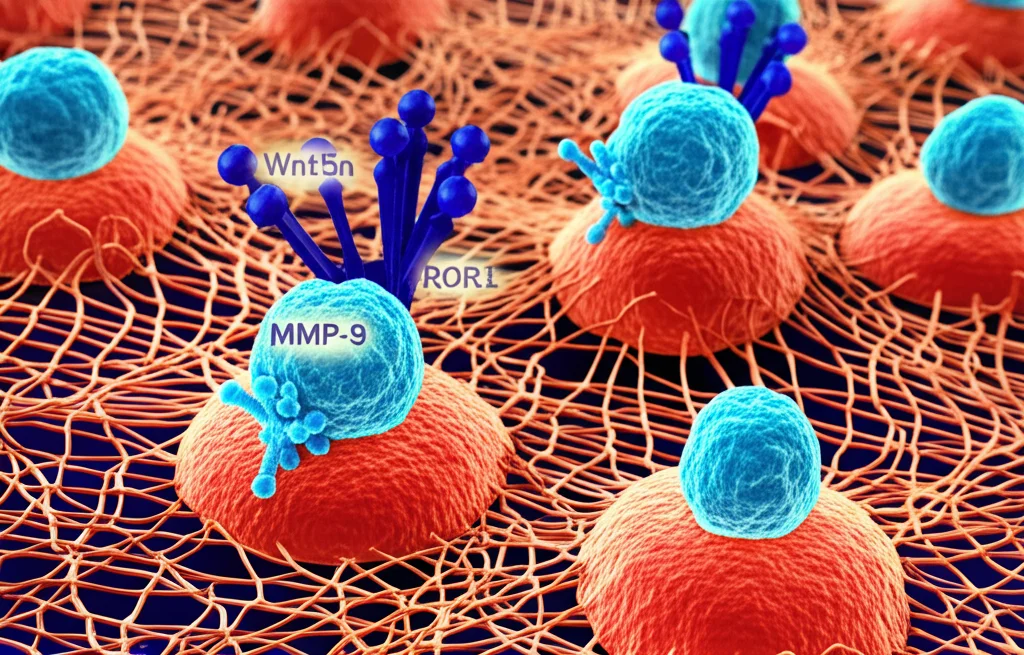
Il “Passaporto” delle Cellule LLC: MMP-9
Immaginate le cellule della LLC come dei viaggiatori clandestini nel nostro organismo. Per spostarsi dal sangue ai tessuti linfoidi (come midollo osseo, linfonodi, milza), dove trovano un ambiente accogliente per crescere e sopravvivere, devono superare delle barriere, un po’ come delle dogane biologiche. Uno strumento chiave che usano per “sfondare” queste barriere, in particolare la matrice extracellulare (una specie di impalcatura che tiene insieme i tessuti), è un enzima chiamato Matrix Metalloproteinase-9 (MMP-9).
Pensate all’MMP-9 come a una sorta di “grimaldello” molecolare. Studi precedenti hanno già messo in luce una cosa importante: i pazienti le cui cellule LLC producono alti livelli di MMP-9 tendono ad avere una malattia più aggressiva e una prognosi meno favorevole. Questo ci ha fatto drizzare le antenne: cosa regola l’espressione di questo enzima così cruciale?
Un Sospettato Speciale: ROR1
Qui entra in gioco un’altra proteina interessante: ROR1. Si tratta di una proteina di membrana che troviamo espressa in abbondanza sulle cellule della LLC (e su cellule embrionali, da cui il termine “onco-embrionica”), ma quasi per nulla sui tessuti sani di un adulto. È come un’etichetta distintiva delle cellule leucemiche. Anche ROR1 è stato associato a una malattia più aggressiva: chi ha cellule LLC con alti livelli di ROR1 spesso necessita di iniziare la terapia prima e ha una sopravvivenza mediamente più breve.
ROR1 funziona come un recettore, una sorta di antenna sulla superficie cellulare. E chi è il segnale che questa antenna capta? Una molecola chiamata Wnt5a, che si trova in concentrazioni elevate nel sangue dei pazienti con LLC. Wnt5a, legandosi a ROR1, attiva una serie di segnali all’interno della cellula (la cosiddetta via di segnalazione non-canonica di Wnt).
La Scoperta: Il Legame Wnt5a-ROR1-MMP-9
La domanda che ci siamo posti è stata: c’è un legame tra ROR1 e MMP-9? Ebbene sì! Abbiamo scoperto che le cellule LLC che esprimono alti livelli di ROR1 (le chiameremo ROR1Pos) producono anche significativamente più MMP-9 rispetto alle cellule che ne esprimono poco o nulla (ROR1Neg). Questa non è stata solo un’osservazione sui pazienti, ma l’abbiamo confermata anche in modelli animali di leucemia.
Ma la vera chicca è stata vedere cosa succede stimolando le cellule LLC con Wnt5a. Abbiamo visto che Wnt5a è in grado di:
- Aumentare la produzione di MMP-9 all’interno delle cellule.
- Incrementare il rilascio di MMP-9 nell’ambiente circostante (nel “brodo” di coltura, in laboratorio).
- Potenziare la capacità delle cellule LLC di invadere una barriera artificiale (il Matrigel) in un test specifico chiamato Boyden-Chamber Assay.
In pratica, Wnt5a, agendo su ROR1, dà alle cellule LLC gli strumenti (più MMP-9) e la spinta per diventare più invasive.

Resistenza alle Terapie e Nuove Strategie
Ora arriva un punto cruciale. Abbiamo testato se alcuni farmaci comunemente usati per la LLC, gli inibitori di BTK come ibrutinib e zanubrutinib, potessero bloccare questo effetto di Wnt5a. Sorprendentemente, la risposta è stata no! Questi farmaci, pur essendo efficaci su altre vie di segnalazione (come quella attivata dalla chemochina CXCL12, che pure aumenta MMP-9), non impediscono a Wnt5a di potenziare l’espressione di MMP-9 e l’invasività tramite ROR1. Questo potrebbe essere uno dei motivi per cui, a volte, i pazienti sviluppano resistenza a questi trattamenti.
Ma c’è una buona notizia! Un anticorpo umanizzato specifico per ROR1, chiamato zilovertamab, è stato in grado di bloccare completamente l’effetto di Wnt5a. Pre-trattando le cellule con zilovertamab, Wnt5a non riusciva più ad aumentare MMP-9 né a rendere le cellule più invasive. Questo suggerisce che colpire ROR1 potrebbe essere una strategia terapeutica valida, magari proprio in combinazione con gli inibitori di BTK. Infatti, abbiamo visto che usare zilovertamab e ibrutinib insieme ha un effetto additivo nel bloccare l’invasività cellulare, suggerendo che agiscono su meccanismi complementari.
Il Regista Occulto: NF-κB
Ma come fa esattamente il segnale Wnt5a/ROR1 ad aumentare MMP-9? Abbiamo scavato più a fondo e abbiamo identificato un altro attore chiave: il fattore di trascrizione NF-κB. NF-κB è come un interruttore generale che controlla l’accensione e lo spegnimento di molti geni, incluso quello per MMP-9 (il gene MMP9 ha proprio un sito di legame per NF-κB nel suo promotore, la regione che ne regola l’attivazione).
Abbiamo scoperto che Wnt5a, tramite ROR1, attiva NF-κB (in particolare, ne induce la fosforilazione, un segnale di attivazione, sulla subunità p65). E bloccando NF-κB, o con un inibitore chimico specifico (CAS 545380-34-5) o “spegnendo” il gene per NF-κB-p65 con la tecnica del silenziamento genico (siRNA), abbiamo impedito a Wnt5a di aumentare MMP-9 e l’invasività. Voilà! Il meccanismo è svelato: Wnt5a → ROR1 → attivazione di NF-κB → aumento della produzione di MMP-9 → maggiore invasività.

Importante sottolineare che anche bloccando direttamente MMP-9 (con un inibitore specifico, CAS 1177749-58-4, o con siRNA) si riduceva l’invasività indotta da Wnt5a, confermando che MMP-9 è proprio l’effettore finale di questa cascata.
Il Contesto è Tutto: Il Microambiente Tumorale
Le cellule LLC non vivono isolate. Nel midollo osseo e nei linfonodi interagiscono con altre cellule, come le cellule stromali mesenchimali (MSC) e le cellule “nutrici” (Nurse-Like Cells, NLC). Queste cellule “amiche” della leucemia creano un microambiente favorevole e, guarda caso, rilasciano proprio Wnt5a e altre molecole (come CXCL12) che aiutano le cellule LLC.
Abbiamo infatti visto che il “brodo” di coltura in cui erano cresciute le MSC (MSC-CM) o le NLC (NLC-CM) aumentava l’espressione di MMP-9 e l’invasività delle cellule LLC. E, ancora una volta, zilovertamab (l’anti-ROR1) riusciva a bloccare questo effetto indotto dal microambiente, mentre ibrutinib lo faceva solo parzialmente (probabilmente bloccando l’effetto di CXCL12 ma non quello di Wnt5a). L’uso combinato di zilovertamab e ibrutinib si è dimostrato ancora più efficace nel contrastare l’invasività promossa dal microambiente.
Cosa Ci Portiamo a Casa?
Insomma, il nostro studio ha svelato un meccanismo nuovo e importante attraverso cui le cellule della Leucemia Linfatica Cronica aumentano la loro capacità di invadere i tessuti. La via Wnt5a/ROR1, attivando NF-κB, porta a una maggiore produzione e rilascio dell’enzima “grimaldello” MMP-9. Questo processo contribuisce all’aggressività della malattia e, cosa fondamentale, non viene bloccato dagli attuali inibitori di BTK.

Questa scoperta apre scenari interessanti:
- Spiega un potenziale meccanismo di resistenza agli inibitori di BTK.
- Identifica ROR1 come un bersaglio terapeutico promettente.
- Suggerisce che una terapia combinata (ad esempio, zilovertamab + inibitore di BTK) potrebbe essere più efficace nel bloccare la progressione della LLC, colpendo contemporaneamente diverse vie che promuovono l’invasività.
È affascinante vedere come, pezzo dopo pezzo, riusciamo a capire meglio i trucchi che queste cellule usano per sopravvivere e diffondersi. Ogni scoperta è un passo avanti verso terapie più mirate ed efficaci per i pazienti. Continuiamo a indagare!
Fonte: Springer