Il Trucco del Virus Spumoso: Come la Proteina Gag Scatena le “Pulizie Cellulari” per Nascondersi Meglio
Ragazzi, il mondo dei virus è un posto incredibilmente affascinante e, a volte, un po’ inquietante. Ci sono questi agenti microscopici che hanno sviluppato strategie sopraffine per infiltrarsi nelle nostre cellule e fare i loro comodi. Oggi voglio parlarvi di una scoperta recente che mi ha lasciato a bocca aperta e che riguarda un tipo particolare di retrovirus, il cosiddetto “virus spumoso” o Foamy Virus (PFV), e un meccanismo cellulare fondamentale: la mitofagia.
Virus Antichi e Misteri Persistenti
I virus spumosi sono tra i retrovirus più antichi che conosciamo. Pensate, esistono da un’eternità! Una delle loro caratteristiche più interessanti è la capacità di stabilire un’infezione latente: una volta entrati nell’ospite, possono rimanere lì, buoni buoni, per tutta la vita, senza dare troppi problemi apparenti. Ma come ci riescono? Qual è il loro segreto per questa convivenza a lungo termine? Questo è uno dei misteri che noi scienziati stiamo cercando di svelare.
In passato, avevamo già notato che l’infezione da PFV sembrava stimolare un processo chiamato autofagia, una sorta di “servizio di pulizia” generale della cellula che elimina componenti danneggiati o inutili. Ma c’è un tipo di pulizia ancora più specifico, mirato alle centrali energetiche della cellula: i mitocondri. Questo processo si chiama mitofagia. Immaginate le vostre cellule che decidono di rottamare selettivamente solo i mitocondri vecchi o danneggiati per mantenere tutto in ordine ed efficiente. La domanda che ci siamo posti è stata: il PFV c’entra qualcosa anche con la mitofagia?
PFV all’Attacco: Mitocondri Sotto Stress
Ebbene sì, sembra proprio di sì! Le nostre ricerche hanno mostrato che quando il PFV infetta le cellule (nel nostro caso, abbiamo usato una linea cellulare chiamata HT1080, particolarmente suscettibile a questo virus), succede qualcosa ai mitocondri. Iniziano a mostrare segni di sofferenza: producono più “scorie” reattive, i cosiddetti mtROS (specie reattive dell’ossigeno mitocondriale), che sono un chiaro segnale di danno.
Non solo. Abbiamo osservato che, con il passare del tempo dall’infezione (24 e 48 ore), aumentavano i segnali tipici della mitofagia. Proteine come p62 e LC3, che sono un po’ le “etichette” che la cellula appiccica sui componenti da eliminare tramite autofagia, si accumulavano proprio sui mitocondri danneggiati. Era come se la cellula stesse dicendo: “Ok, questi mitocondri sono andati, prepariamoli per lo smaltimento!”. Quindi, la prima parte del puzzle era chiara: l’infezione da PFV induce la mitofagia. Ma chi è il responsabile diretto all’interno del virus?
Gag: Il Sospettato Numero Uno Diventa Protagonista
I retrovirus hanno diverse proteine nel loro “arsenale”. Una delle più importanti è la proteina Gag. Questa proteina è fondamentale per l’assemblaggio di nuove particelle virali. Sapevamo già da studi precedenti che Gag interagisce con il sistema di trasporto interno della cellula (gli endosomi) e promuove l’autofagia. Poteva essere lei la chiave anche per la mitofagia?
Abbiamo deciso di indagare. Invece di usare il virus intero, abbiamo fatto esprimere solo la proteina Gag nelle cellule (questa volta, cellule HEK293T). I risultati sono stati sorprendenti! La sola presenza di Gag era sufficiente a causare danni ai mitocondri: aumentavano le scorie mtROS, diminuiva il potenziale di membrana (un indicatore della salute mitocondriale) e addirittura pezzi di DNA mitocondriale venivano rilasciati nel citoplasma della cellula. E tutto questo avveniva in modo dose-dipendente: più Gag producevamo nelle cellule, più i mitocondri soffrivano.

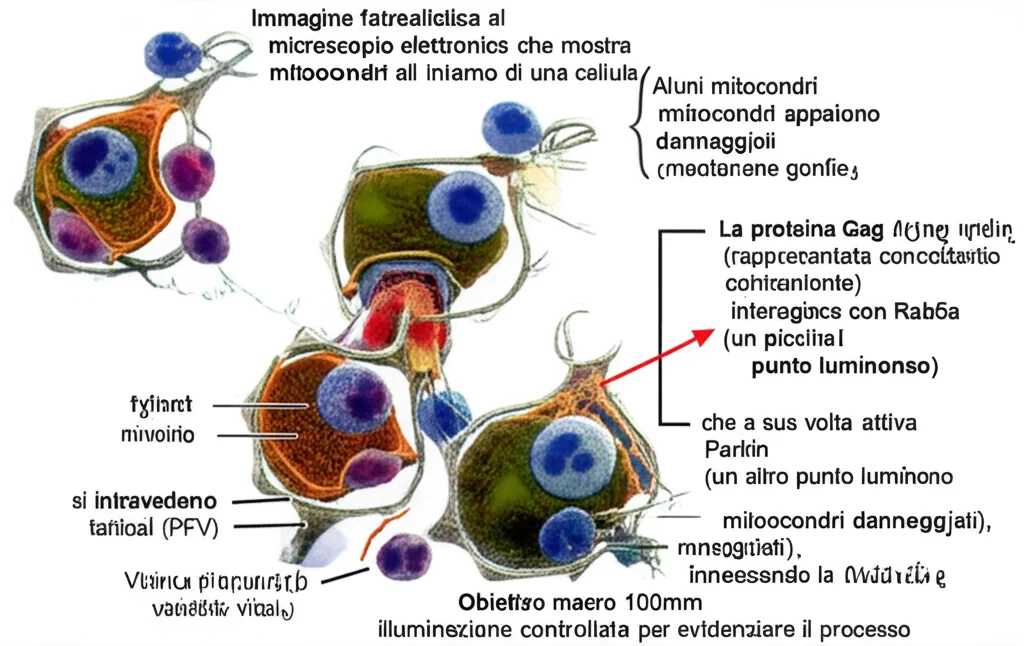
Ma non finisce qui. L’espressione di Gag da sola attivava anche tutti i segnali della mitofagia che avevamo visto con l’infezione virale completa: aumento della forma “attiva” di LC3 (LC3-II), degradazione di p62 e, soprattutto, un massiccio spostamento di LC3 e p62 dal citoplasma ai mitocondri. Usando tecniche di microscopia avanzata (confocale), abbiamo potuto vedere proprio LC3 (marcata con fluorescenza) “abbracciare” i mitocondri (marcati con un’altra proteina, Tom20). Inoltre, i livelli di proteine mitocondriali come Tom20 (membrana esterna) e Cox4 (membrana interna) diminuivano, segno che i mitocondri venivano effettivamente degradati. Per essere sicurissimi, abbiamo bloccato una proteina essenziale per l’autofagia (Atg5) e abbiamo visto che questo impediva la degradazione dei mitocondri indotta da Gag. Insomma, non c’erano dubbi: Gag è il motore che scatena la mitofagia.
Come Fa Gag? La Via di Parkin e il Ruolo di Rab5a
Ok, Gag induce mitofagia. Ma come? Esistono diverse strade che la cellula può usare per questo processo. Una delle più studiate è la via PINK1-Parkin. In breve: quando un mitocondrio è danneggiato, la proteina PINK1 si accumula sulla sua superficie e recluta Parkin, una sorta di “etichettatore” che marca il mitocondrio per la distruzione.
Abbiamo controllato se Gag attivasse questa via. E sì! Nelle cellule che esprimevano Gag, i livelli di PINK1 e Parkin sui mitocondri aumentavano significativamente. La prova del nove? Abbiamo usato delle tecniche per “spegnere” il gene di Parkin (knockdown). In queste cellule senza Parkin funzionante, Gag non riusciva più a indurre la degradazione dei mitocondri né l’accumulo di LC3 su di essi. Questo ci dice che Gag sfrutta proprio la via Parkin-dipendente per attivare la mitofagia.
Ma c’era ancora un pezzo mancante. Come fa Gag ad attivare questa via? Abbiamo notato che nelle cellule con Gag, un’altra proteina aumentava parecchio: Rab5a. Rab5a è una piccola proteina GTPasi coinvolta nel traffico di vescicole all’interno della cellula, in particolare nella formazione degli endosomi precoci. Poteva essere lei l’anello di congiunzione?
Ancora una volta, esperimenti mirati ci hanno dato la risposta. Se bloccavamo Rab5a (con shRNA), l’effetto di Gag sulla mitofagia veniva annullato! La degradazione di p62 e Tom20 si fermava, LC3 non si attivava e non si accumulava più sui mitocondri. Al contrario, se aumentavamo artificialmente Rab5a, ottenevamo effetti simili a quelli di Gag. Quindi, la sequenza sembra essere questa: Gag fa aumentare Rab5a, e Rab5a in qualche modo facilita l’attivazione della mitofagia Parkin-dipendente. Questo è un meccanismo davvero inedito per un retrovirus!
Perché il Virus Fa Tutto Questo? Un Trucco per Sopravvivere
Ma arriviamo alla domanda da un milione di dollari: perché il PFV, tramite la sua proteina Gag, si dà tanto da fare per scatenare la mitofagia? L’ipotesi più intrigante è che questo processo aiuti il virus a sopravvivere meglio e a stabilire quella famosa infezione latente.
Come? I mitocondri non sono solo centrali energetiche, ma sono anche piattaforme cruciali per la risposta immunitaria innata della cellula, in particolare per la produzione di interferoni di tipo I, molecole che allertano il sistema immunitario della presenza di un’infezione virale. Eliminando i mitocondri danneggiati (che potrebbero essere proprio quelli che “sentono” l’infezione e lanciano l’allarme), il virus potrebbe riuscire a smorzare la risposta immunitaria dell’ospite. E infatti, abbiamo osservato che l’espressione di Gag riduceva la produzione di interferone beta (IFNB) e di altre molecole infiammatorie (CXCL5, CXCL10).
Quindi, inducendo la mitofagia, Gag potrebbe creare un ambiente più “tranquillo” per il virus, permettendogli di replicarsi indisturbato o di entrare in latenza senza essere eliminato dalle difese cellulari. Un trucco davvero astuto!
Questa scoperta non solo ci aiuta a capire meglio come funzionano i virus spumosi e le loro interazioni con le cellule ospiti, ma apre anche nuove prospettive. Potremmo, in futuro, pensare a strategie terapeutiche che interferiscano con questo meccanismo per combattere le infezioni da PFV o forse anche da altri retrovirus che potrebbero usare strategie simili. È un campo di ricerca in continua evoluzione, ed è emozionante essere parte di questa avventura scientifica!
Fonte: Springer