Virus Sikamat: Un Nuovo Alleato Contro la Leucemia e le Cellule Staminali Tumorali?
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo dalla ricerca medica: l’uso di virus per combattere il cancro. Sì, avete capito bene! In particolare, ci concentreremo su un virus chiamato Sikamat (PRV7S) e sul suo potenziale contro un nemico ostico come la leucemia.
La Leucemia: Una Sfida Globale
Prima di tuffarci nel vivo, un piccolo ripasso. La leucemia è un gruppo di tumori maligni che colpiscono il sangue e il midollo osseo. È una preoccupazione sanitaria globale, con la leucemia mieloide acuta (LMA) e la leucemia mieloide cronica (LMC) tra le forme più note. Pensate che negli Stati Uniti, la LMA è stata la forma con la più alta incidenza e mortalità nel 2019. A livello globale, nel 2022, la leucemia era al 13° posto per incidenza e al 10° per mortalità. Purtroppo, le terapie convenzionali come chemio e radioterapia non sempre riescono a eradicare completamente la malattia, anzi, a volte possono persino aumentare il rischio di svilupparla. C’è un bisogno disperato di nuove strategie terapeutiche.
Il Problema della Resistenza e le Cellule Staminali Tumorali (CSC)
Uno dei motivi principali per cui la leucemia è così difficile da sconfiggere è la resistenza alle terapie. E qui entrano in gioco le cosiddette cellule staminali tumorali (CSC), conosciute anche come cellule iniziatrici del tumore (TIC). Queste cellule, identificate sia nella LMA che nella LMC, sono particolarmente resistenti alla chemioterapia e sono considerate le principali responsabili delle recidive e della mortalità dei pazienti. Colpire specificamente le CSC è una delle sfide più grandi dell’oncologia moderna. Immaginatele come le “regine” del tumore: se non eliminate loro, il tumore può rigenerarsi. Recentemente, è stato creato un modello di cellule staminali pluripotenti indotte (iPSC) derivato da una LMA (sottotipo M5, linea THP-1), che si pensa assomigli molto a queste CSC. L’idea è che se una terapia funziona contro questo modello, potrebbe funzionare anche contro le vere CSC.
Virus Oncolitici: Un’Arma Biologica Contro il Cancro
Ed ecco che arriviamo ai virus oncolitici (OV). Si tratta di virus, naturali o modificati geneticamente, che hanno una predilezione speciale per le cellule tumorali. Le infettano, si replicano al loro interno e le distruggono (un processo chiamato oncolisi), spesso stimolando anche una risposta immunitaria contro il tumore. Un esempio famoso è T-VEC, approvato dalla FDA per il trattamento del melanoma. Anche diversi reovirus (come MRV, ARV e PRV) hanno mostrato proprietà oncolitiche. Tra questi, il Pteropine orthoreovirus (PRV), a cui appartiene il nostro protagonista, il virus Sikamat (PRV7S).
Virus Sikamat (PRV7S) alla Prova: Infezione e Morte Cellulare
Nel nostro studio, abbiamo voluto vedere cosa succede mettendo PRV7S a contatto con cellule di leucemia mieloide. Abbiamo usato due linee cellulari comuni: THP-1 (LMA) e K562 (LMC). I risultati sono stati davvero incoraggianti! Abbiamo osservato che PRV7S è in grado di infettare queste cellule leucemiche, replicarsi al loro interno e, cosa più importante, ridurre la loro vitalità. Al microscopio, abbiamo visto chiaramente i segni dell’attacco virale (l’effetto citopatico, o CPE): le cellule THP-1 infette diventavano allungate, alcune addirittura aderenti al fondo della piastra (cosa insolita per cellule che normalmente fluttuano), mentre le K562 mostravano rigonfiamenti della membrana (blebbing) e lisi cellulare. La vitalità delle cellule infette diminuiva nel tempo, come confermato da diversi test (MTT, trypan blue, ioduro di propidio).
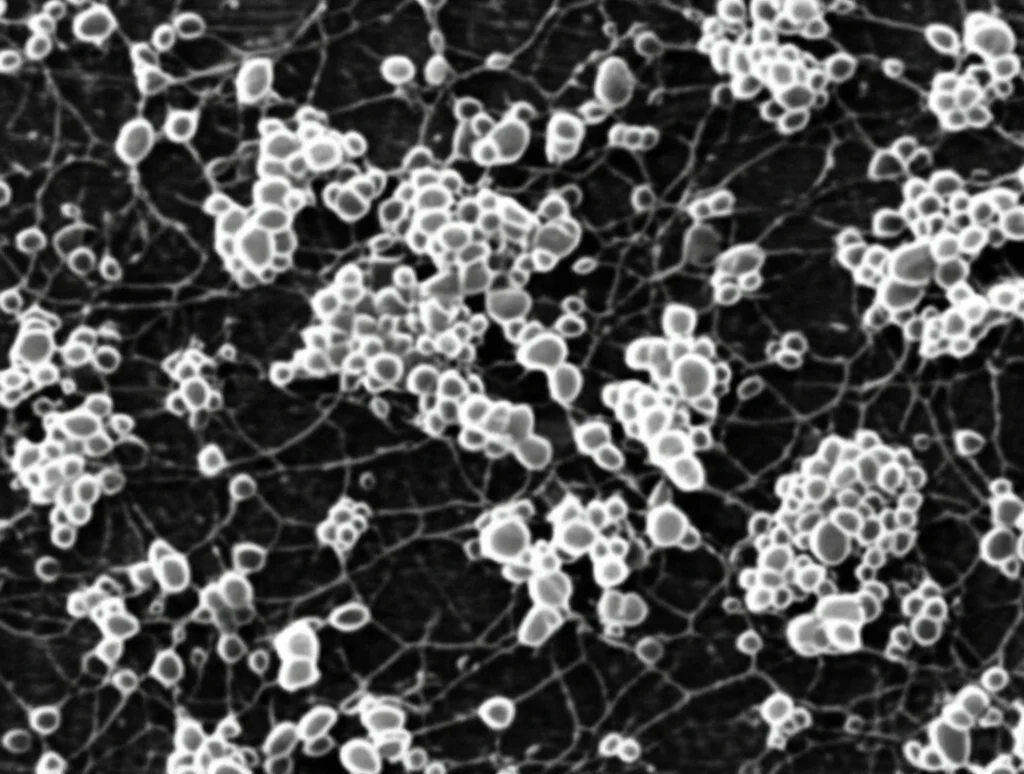
Replicazione Virale: Efficace ma non Persistente
Abbiamo anche misurato quanto bene il virus si replicasse. Sia il titolo virale extracellulare (quanti virus funzionanti vengono rilasciati) sia l’RNA virale intracellulare aumentavano dopo l’infezione, indicando una replicazione attiva. Curiosamente, le cellule K562 sembravano essere più permissive all’infezione e producevano più virus rispetto alle THP-1. Un aspetto importante è che, nonostante la replicazione efficiente, l’infezione da PRV7S non sembrava diventare persistente. Dopo un picco iniziale, i livelli di RNA virale diminuivano fino a diventare non rilevabili dopo circa 21 giorni, probabilmente perché la maggior parte delle cellule infette era stata lisata. Questo è un buon segno, perché suggerisce che il virus fa il suo lavoro e poi scompare, senza rimanere indefinitamente nell’organismo.
Come Uccide PRV7S? Apoptosi e Altre Vie
Ok, il virus uccide le cellule tumorali, ma come? Abbiamo usato la citometria a flusso per analizzare i tipi di morte cellulare. I risultati hanno mostrato un aumento sia della necrosi (una morte cellulare più “disordinata”) nelle cellule THP-1, sia dell’apoptosi (una forma di “suicidio cellulare” programmato) nelle K562. L’apoptosi sembrava coinvolgere le caspasi, enzimi chiave in questo processo. Infatti, abbiamo misurato un aumento dell’attività delle caspasi-3 e -7 nelle cellule infette.
Per capire ancora più a fondo, abbiamo fatto analisi trascrittomiche (guardando l’espressione dei geni, mRNA) e proteomiche (guardando i livelli delle proteine). Queste analisi hanno rivelato che l’infezione da PRV7S altera diverse vie cellulari legate alla morte, non solo l’apoptosi ma potenzialmente anche la necroptosi, piroptosi, ferroptosi e autofagia. È un quadro complesso!
Un dato interessante è che l’infezione non causava un arresto significativo del ciclo cellulare. Questo potrebbe essere vantaggioso, perché a volte l’arresto del ciclo cellulare può ritardare l’apoptosi nelle cellule cancerose.
Attacco alle Cellule Staminali Tumorali (hiPSC)
Ricordate il modello di CSC derivato dalla LMA (le cellule hiPSC)? Abbiamo testato PRV7S anche su di loro. Ebbene, il virus è stato in grado di infettare, replicarsi ed eliminare anche queste cellule “regine”! Anche a basse concentrazioni virali, abbiamo visto la formazione di placche (zone di lisi cellulare) nelle colonie di hiPSC. L’attività delle caspasi-3/7 aumentava anche in queste cellule, suggerendo che l’apoptosi fosse coinvolta. Questo è un risultato potenzialmente importantissimo, perché colpire le CSC potrebbe essere la chiave per prevenire le recidive e superare la chemioresistenza.
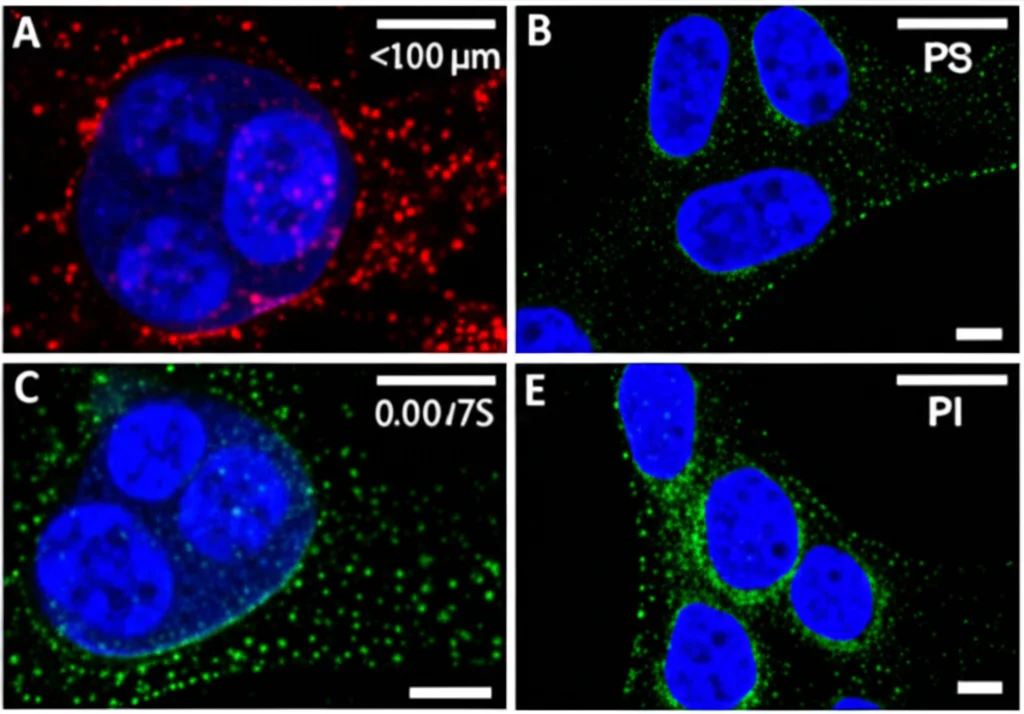
La Prova del Nove: La Sicurezza in Vivo
Tutto molto bello in provetta, ma come si comporta il virus in un organismo complesso? La sicurezza è fondamentale. Abbiamo condotto uno studio su topi immunocompetenti (BALB/c). Abbiamo somministrato loro PRV7S (a una concentrazione piuttosto alta) per via intraperitoneale (nella pancia) e intranasale (nel naso). Li abbiamo monitorati per 14 giorni. I risultati sono stati ottimi:
- 100% di sopravvivenza in tutti i gruppi.
- Nessuna perdita di peso significativa (solo un leggero calo temporaneo nel gruppo intranasale).
- Nessun danno tissutale significativo negli organi esaminati (cervello, cuore, polmoni, fegato, milza, intestino, reni) all’analisi istopatologica.
- Nessuna traccia di RNA virale rilevata negli organi dopo 14 giorni, confermando l’assenza di infezione persistente.
Questi dati suggeriscono che PRV7S ha un profilo di sicurezza favorevole, almeno in questo modello animale.
Cosa Abbiamo Imparato e Cosa Ci Aspetta
Questo studio ci dice che il virus Sikamat (PRV7S) è un candidato promettente come agente oncolitico per la leucemia mieloide. È capace di infettare e uccidere sia le cellule leucemiche “comuni” sia, cosa cruciale, un modello di cellule staminali tumorali. La morte cellulare indotta è complessa e coinvolge principalmente l’apoptosi mediata da caspasi, ma forse anche altre vie. Inoltre, il virus sembra sicuro e non persistente in un modello murino.
Certo, ci sono delle limitazioni. Le analisi molecolari sono state fatte in un solo momento, e la relazione tra geni e proteine è complessa (abbiamo notato discrepanze, forse dovute a meccanismi di regolazione come feedback negativi o stabilità differenziale di mRNA/proteine). Lo studio sulla sicurezza è stato fatto su topi sani; manca ancora la prova dell’efficacia *in vivo* su topi con leucemia indotta. Bisognerà anche studiare meglio l’interazione con il sistema immunitario, che gioca un ruolo chiave nell’efficacia delle viroterapie oncolitiche.

Il prossimo passo? Approfondire questi meccanismi, testare PRV7S in modelli animali di leucemia più complessi e valutare come potenziare la sua azione, magari in combinazione con altre terapie. La strada verso la clinica è ancora lunga, ma i risultati sono entusiasmanti e aprono nuove prospettive nella lotta contro questa terribile malattia. Chissà, forse un giorno avremo davvero un virus come nostro alleato!
Fonte: Springer