Vescicole Probiotiche: La Nuova Frontiera Contro il Danno Polmonare Acuto?
Ragazzi, tenetevi forte perché oggi vi parlo di una scoperta che potrebbe davvero cambiare le carte in tavola per una condizione medica piuttosto seria: il danno polmonare acuto (ALI). Sapete, nonostante i passi da gigante nella comprensione di come funzioni l’ALI, le terapie che abbiamo oggi sono più che altro di supporto. C’è un bisogno disperato di trattamenti innovativi, e indovinate un po’? La risposta potrebbe arrivare da un posto inaspettato: il nostro intestino, o meglio, dai suoi piccoli abitanti benefici!
Un Aiuto dai Probiotici: Le Vescicole Extracellulari
Avete presente i probiotici? Quei microrganismi “buoni” che fanno tanto bene alla nostra salute? Bene, uno di questi, il Lactiplantibacillus plantarum (chiamiamolo Lp per comodità), produce delle minuscole “bollicine” chiamate vescicole extracellulari (EVs). Pensatele come dei messaggeri microscopici che trasportano molecole bioattive. Nel nostro studio, abbiamo voluto vedere se queste vescicole, che chiameremo LpEVs, potessero dare una mano in caso di ALI.
Abbiamo quindi preso dei topolini e indotto in loro un danno polmonare acuto usando il lipopolisaccaride (LPS), una molecola che scatena una forte infiammazione. Poi, ad alcuni di questi topolini abbiamo somministrato le nostre LpEVs. I risultati? Sorprendenti! I topolini trattati con LpEVs mostravano:
- Una significativa riduzione del danno ai polmoni (visibile anche al microscopio!).
- Meno marcatori infiammatori in circolo.
- Una minore evidenza di un processo chiamato ferroptosi.
Insomma, sembrava proprio che queste vescicole avessero un effetto protettivo notevole!
Ma Cos’è la Ferroptosi e Cosa C’entrano i Macrofagi?
Ok, fermi tutti. Cos’è questa ferroptosi? È un tipo particolare di morte cellulare programmata che dipende dal ferro e coinvolge l’ossidazione dei grassi (lipidi). Sta emergendo come un attore chiave in diverse malattie, inclusa l’ALI.
E i macrofagi? Sono cellule del nostro sistema immunitario, dei veri e propri “spazzini” ma anche “direttori d’orchestra” della risposta infiammatoria nei polmoni. Possono essere di due tipi principali:
- M1 (pro-infiammatori): Diciamo che sono quelli che “urlano” e chiamano all’attacco, utili all’inizio ma dannosi se esagerano.
- M2 (anti-infiammatori): Sono quelli che “calmano le acque” e aiutano a riparare i danni.
Nell’ALI, spesso c’è uno sbilanciamento verso i macrofagi M1, che peggiora l’infiammazione e il danno. La ferroptosi sembra spingere i macrofagi proprio verso questo stato M1.

Come Agiscono le LpEVs: Stop alla Ferroptosi!
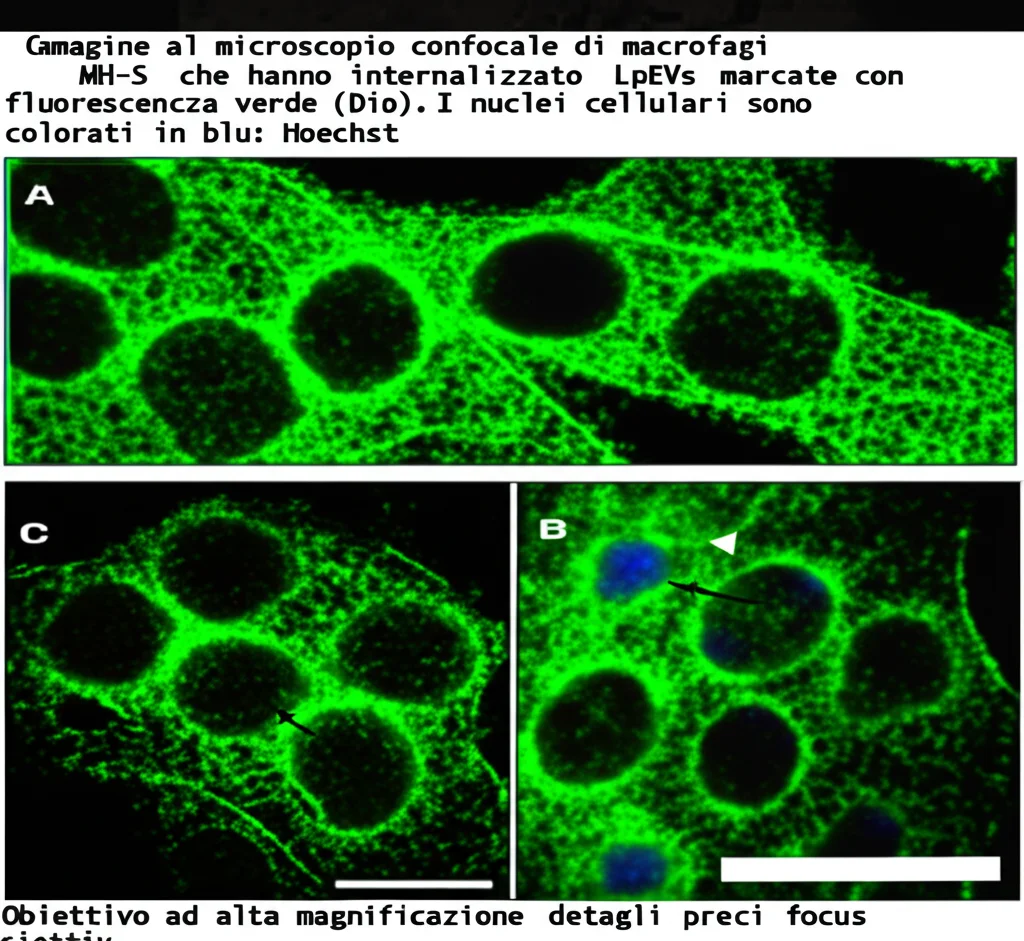
Tornando ai nostri esperimenti, abbiamo visto che le LpEVs non solo proteggevano i polmoni dei topolini, ma agivano anche direttamente sui macrofagi (studiati in vitro, cioè in laboratorio). Cosa facevano?
- Frenavano la ferroptosi nei macrofagi.
- Spingevano i macrofagi verso il fenotipo M2, quello anti-infiammatorio.
Ma come ci riuscivano? Abbiamo scavato più a fondo. Sembra che le LpEVs attivino una via di difesa antiossidante molto importante nelle cellule, quella legata a NRF2 e HO-1. Queste molecole aiutano la cellula a combattere lo stress ossidativo, che è un fattore chiave nella ferroptosi. Inoltre, le LpEVs rafforzavano l’asse anti-ferroptotico System Xc-/GPX4. GPX4 è una proteina cruciale che previene l’ossidazione dei lipidi tipica della ferroptosi.
Il Messaggio Segreto nelle Vescicole: cbn-let-7
La vera chicca, però, l’abbiamo scoperta analizzando il contenuto delle LpEVs. Queste vescicole sono piene di molecole, tra cui i microRNA (miRNA), piccoli frammenti di RNA che possono regolare l’espressione dei geni nelle cellule riceventi. Abbiamo trovato che un miRNA specifico, chiamato cbn-let-7, era particolarmente abbondante nelle nostre LpEVs.
E indovinate quale gene bersaglia questo cbn-let-7? Proprio ACSL4, un gene che invece promuove la ferroptosi! In pratica, le LpEVs consegnano questo miRNA ai macrofagi. Una volta dentro, cbn-let-7 “spegne” ACSL4, mettendo così un freno alla ferroptosi. Abbiamo confermato questo meccanismo con esperimenti specifici, dimostrando che se bloccavamo l’azione di cbn-let-7, l’effetto protettivo delle LpEVs sulla ferroptosi diminuiva.
L’Asse Intestino-Polmone e le Prospettive Future
Questa scoperta è affascinante anche perché si collega al concetto di asse intestino-polmone. Sempre più studi dimostrano che la salute del nostro microbiota intestinale influenza quella dei nostri polmoni. I probiotici e i loro derivati, come le LpEVs, potrebbero essere un modo per modulare positivamente questo asse e trattare malattie polmonari.
Il fatto che queste vescicole derivino da un probiotico ampiamente usato e sicuro (L. plantarum si trova comunemente negli alimenti fermentati e nel nostro tratto gastrointestinale) le rende candidate particolarmente interessanti. Potrebbero offrire un approccio terapeutico potenzialmente più sicuro e magari anche meno costoso rispetto ad altre strategie basate su cellule staminali, ad esempio.

Certo, siamo ancora all’inizio. Questa ricerca è stata fatta su modelli animali e cellulari. Serviranno ulteriori studi per capire tutti i dettagli e, soprattutto, per vedere se questi risultati si possono tradurre in terapie efficaci per i pazienti con ALI. Ma la strada sembra promettente! L’idea di usare “messaggeri” prodotti dai nostri batteri buoni per combattere un danno polmonare grave è a dir poco entusiasmante. Chissà che in futuro non potremo curare i polmoni… partendo dall’intestino!
Fonte: Springer