I Segreti della Mandibola: Come Minuscole Vescicole Guidano lo Sviluppo dei Nostri Denti!
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo dello sviluppo dentale. Pensate ai denti: strutture incredibilmente complesse e resistenti che spuntano quasi per magia durante la crescita. Ma vi siete mai chiesti come si formano esattamente? E se vi dicessi che la nostra mandibola, l’osso mascellare inferiore, gioca un ruolo da protagonista molto più attivo di quanto immaginassimo? Preparatevi, perché stiamo per scoprire qualcosa di sorprendente!
Il Dialogo Nascosto tra Mandibola e Denti
Da sempre sappiamo che lo sviluppo dei denti è un processo complesso, frutto di un dialogo continuo tra diversi tipi di tessuti, in particolare tra l’epitelio (il tessuto di rivestimento) e il mesenchima (un tipo di tessuto connettivo embrionale). Queste interazioni sono fondamentali per dare forma e funzione ai nostri futuri denti. Tuttavia, il ruolo specifico della mandibola, pur essendo fisicamente e funzionalmente vicinissima ai denti in formazione, è rimasto a lungo un po’ nell’ombra.
Recentemente, però, la ricerca ha iniziato a svelare dettagli incredibili. Sembra proprio che la mandibola non sia solo un “supporto passivo”, ma un vero e proprio direttore d’orchestra che invia segnali cruciali ai germi dentali in sviluppo. E come comunica? Attraverso delle minuscole “navicelle” chiamate vescicole extracellulari (EVs).
Cosa Sono le Vescicole Extracellulari (EVs)?
Immaginate le cellule come piccole città indaffarate. Le EVs sono come dei pacchi postali che le cellule si scambiano, contenenti istruzioni sotto forma di proteine, lipidi e, soprattutto, materiale genetico come i microRNA (miRNA). Queste vescicole viaggiano nel corpo e, quando raggiungono la cellula bersaglio giusta, consegnano il loro carico, influenzandone il comportamento.
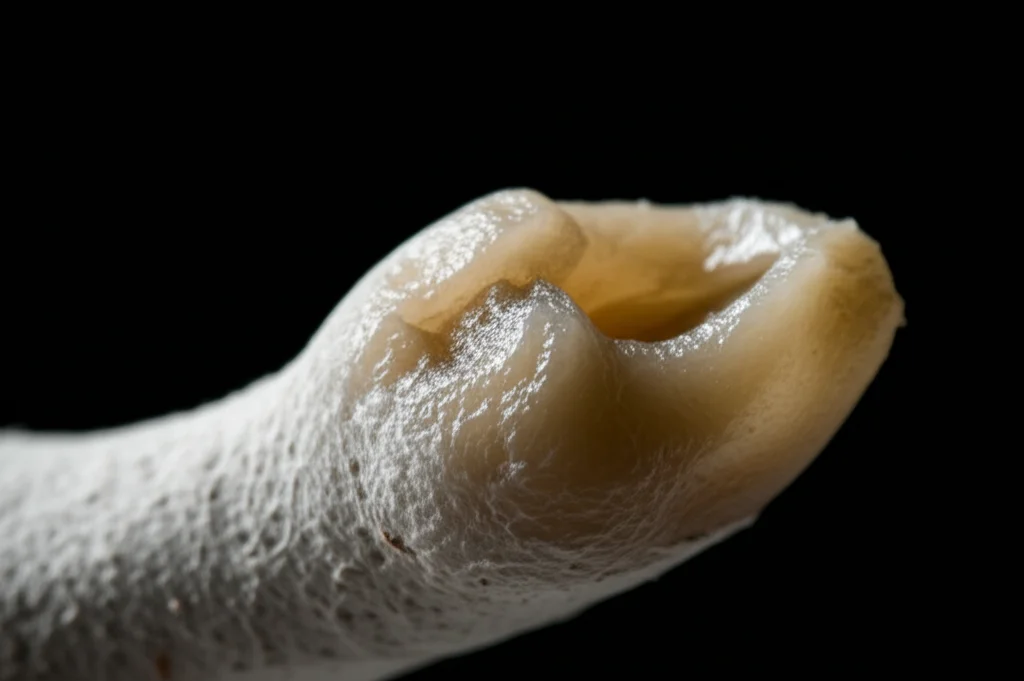
Nel nostro caso, i ricercatori hanno scoperto che le cellule della mandibola di maialini nani (usati come modello perché il loro sviluppo dentale è simile a quello umano) rilasciano queste EVs. Hanno isolato queste vescicole e le hanno osservate al microscopio: piccole sfere di circa 50-150 nanometri (miliardesimi di metro!), con una superficie un po’ ruvida, composte principalmente da lipidi e proteine. Minuscole, ma potentissime!
L’Esperimento Chiave: Mandibola Sì, Mandibola No
Per capire l’importanza di queste EVs mandibolari, i ricercatori hanno fatto un esperimento ingegnoso. Hanno preso dei germi dentali di maialino nano in una fase molto precoce dello sviluppo (lo stadio di “gemma”, E40, cruciale per forma e mineralizzazione future) e li hanno coltivati in laboratorio. Alcuni li hanno coltivati insieme a tessuto mandibolare o direttamente con le EVs isolate dalla mandibola. Altri, invece, li hanno coltivati con la mandibola ma aggiungendo una sostanza (GW4869) che blocca il rilascio delle EVs.
Dopo la coltura, hanno trapiantato questi germi dentali sotto la pelle di topi “nudi” (senza sistema immunitario, per evitare rigetti) e hanno aspettato otto settimane per vedere come si sviluppavano i denti. I risultati sono stati sbalorditivi!
I denti coltivati con la mandibola o le sue EVs si sono sviluppati abbastanza normalmente, formando premolari riconoscibili. Ma quelli del gruppo in cui il rilascio di EVs era stato bloccato? Erano decisamente più piccoli e presentavano anomalie morfologiche evidenti. Non solo: usando una micro-TAC (una TAC ad altissima risoluzione), hanno visto che anche la quantità di tessuto mineralizzato (smalto e dentina, le parti dure del dente) era significativamente ridotta. Era chiaro: senza i messaggi portati dalle EVs della mandibola, lo sviluppo dentale andava storto.

Come Agiscono le EVs? Regolando Crescita e Specializzazione
Ma cosa fanno esattamente queste EVs una volta arrivate alle cellule del germe dentale, in particolare alle cellule mesenchimali dentali (quelle che daranno origine a dentina, polpa, cemento)? I ricercatori hanno indagato anche questo. Hanno scoperto che le EVs mandibolari hanno un effetto sorprendente:
- Riducono la proliferazione cellulare: In pratica, dicono alle cellule mesenchimali di “rallentare la crescita”. Lo hanno visto misurando quante cellule si stavano duplicando (test EdU) e analizzando il ciclo cellulare (citometria a flusso).
- Promuovono la differenziazione odontogenica: Allo stesso tempo, spingono queste cellule a “specializzarsi” per diventare cellule produttrici di dentina. Lo hanno confermato osservando un aumento dei livelli di proteine specifiche della differenziazione dentale, come la DSPP (Dentin Sialophosphoprotein) e la DMP1 (Dentin Matrix Protein 1).
Questo equilibrio tra minor crescita e maggiore specializzazione è fondamentale per ottenere un dente della forma e dimensione corretta, con i tessuti duri ben formati.
Il Bersaglio Molecolare: KDM2B
Ok, le EVs rallentano la crescita e spingono la specializzazione. Ma come? Qual è il meccanismo molecolare? Per scoprirlo, hanno analizzato quali proteine cambiavano all’interno dei germi dentali quando venivano esposti alle EVs mandibolari. Hanno usato una tecnica chiamata spettrometria di massa e hanno notato un cambiamento molto significativo: i livelli di una proteina chiamata KDM2B diminuivano drasticamente.
KDM2B è un tipo di enzima noto come “demetilasi istonica”. Gli istoni sono proteine attorno alle quali si avvolge il DNA nelle nostre cellule, e le modifiche chimiche a questi istoni (come la metilazione o demetilazione) possono accendere o spegnere i geni. KDM2B, in particolare, tende a rimuovere un certo tipo di “etichetta” chimica (chiamata H3K4me3) che di solito è associata a geni attivi.
Quindi, se le EVs mandibolari riducono KDM2B, ci si aspetta che l’etichetta H3K4me3 aumenti, specialmente vicino ai geni importanti per la differenziazione dentale. Ed è esattamente quello che hanno trovato! C’era più H3K4me3 vicino ai geni DSPP e DMP1, suggerendo che questi geni venissero “accesi” più facilmente.
Per confermare il ruolo di KDM2B, hanno fatto l’esperimento opposto: hanno aumentato artificialmente i livelli di KDM2B nelle cellule mesenchimali dentali. Il risultato? Le cellule hanno iniziato a proliferare di più e a differenziarsi di meno (producevano meno DSPP e DMP1). Bingo! KDM2B sembrava essere proprio il bersaglio chiave attraverso cui le EVs mandibolari regolavano il destino delle cellule dentali.

Il Messaggero nel Messaggero: miR-206
Ma come fanno le EVs a ridurre KDM2B? Spesso, le EVs trasportano microRNA (miRNA), piccole molecole di RNA che possono legarsi all’RNA messaggero (mRNA) di un gene specifico e impedirne la traduzione in proteina, di fatto “silenziandolo”.
Analizzando il contenuto di miRNA nelle EVs mandibolari e nei germi dentali esposti a queste EVs, i ricercatori hanno identificato un candidato promettente: miR-206. I livelli di miR-206 erano molto più alti nei germi dentali trattati con le EVs. Poteva essere miR-206 il responsabile della diminuzione di KDM2B?
Hanno verificato se miR-206 potesse legarsi direttamente all’mRNA di KDM2B. Usando un test chiamato “saggio del reporter di luciferasi”, hanno confermato che miR-206 si lega specificamente a una regione precisa dell’mRNA di KDM2B. Inoltre, quando hanno bloccato miR-206 nelle cellule, i livelli di mRNA di KDM2B sono aumentati. La prova era schiacciante: le EVs mandibolari trasportano miR-206, e questo miR-206 entra nelle cellule mesenchimali dentali e spegne il gene KDM2B.
La Prova del Nove: Salvare lo Sviluppo Dentale
Per mettere insieme tutti i pezzi del puzzle, hanno fatto un ultimo, elegantissimo esperimento in vivo. Hanno preso dei germi dentali e li hanno modificati per produrre più KDM2B (il che, come abbiamo visto, ostacola lo sviluppo). Poi, in alcuni di questi germi, hanno anche aggiunto più miR-206. Hanno trapiantato tutto nei topi nudi e hanno aspettato.
Come previsto, i denti con solo KDM2B in eccesso si sono sviluppati male: morfologia alterata, cuspidi meno formate, mineralizzazione ridotta. Ma i denti in cui era stato aggiunto anche miR-206? Sorprendentemente, lo sviluppo era quasi normale! Le cuspidi erano ben formate, la mineralizzazione era recuperata. miR-206 era in grado di “salvare” lo sviluppo dentale contrastando gli effetti negativi dell’eccesso di KDM2B.
Questo ha confermato l’intera catena di eventi: la mandibola rilascia EVs contenenti miR-206 -> miR-206 entra nelle cellule mesenchimali dentali -> miR-206 riduce i livelli di KDM2B -> la riduzione di KDM2B frena la proliferazione e promuove la differenziazione -> il risultato è una corretta morfogenesi e mineralizzazione del dente.

Perché Tutto Questo è Importante?
Questa scoperta è davvero emozionante per diversi motivi:
- Capire lo sviluppo normale: Ci aiuta a comprendere meglio i meccanismi incredibilmente sofisticati che la natura usa per costruire i nostri denti, rivelando un ruolo attivo e inaspettato per la mandibola.
- Spiegare le anomalie: Potrebbe gettare nuova luce su problemi clinici come l’agenesia dentale (la mancanza congenita di uno o più denti), dove forse un difetto in questa comunicazione mandibola-dente potrebbe giocare un ruolo. Identificare il pathway miR-206/KDM2B apre potenziali bersagli terapeutici.
- Migliorare la rigenerazione dentale: La rigenerazione di denti interi è un po’ il Santo Graal dell’odontoiatria. Finora, i tentativi di creare denti bioingegnerizzati hanno spesso prodotto strutture di dimensioni e forma non perfette. Forse mancava proprio questo segnale cruciale dalla “mandibola virtuale”? Incorporare le EVs mandibolari o mimare l’azione di miR-206/KDM2B potrebbe essere la chiave per ottenere denti rigenerati più simili a quelli naturali. Le EVs stesse potrebbero anche essere usate come veicoli per trasportare terapie direttamente alle cellule giuste.
Insomma, abbiamo scoperto che la mandibola non è solo una spettatrice, ma una comunicatrice attiva che, tramite minuscole vescicole cariche di miR-206, orchestra finemente la crescita e la specializzazione delle cellule dentali agendo sul gene KDM2B. È un esempio meraviglioso di come i diversi tessuti del nostro corpo collaborino in modi complessi e affascinanti. Chissà quali altri segreti si nascondono nelle intricate danze molecolari che danno forma alla vita!
Fonte: Springer