Messaggeri di Speranza dalle Cellule Staminali: Come le Vescicole Extracellulari Combattono i Danni Intestinali Bloccando la Ferroptosi
Amici della scienza, preparatevi per un viaggio affascinante nel mondo microscopico del nostro corpo, dove messaggeri minuscoli ma potentissimi stanno aprendo nuove frontiere per la medicina! Oggi vi parlo di una condizione davvero insidiosa, il danno da ischemia-riperfusione intestinale (II/R). Sembra un parolone, ma immaginate che una parte del vostro intestino rimanga senza sangue (ischemia) per un po’, e poi il flusso sanguigno venga ripristinato (riperfusione). Sembrerebbe una buona notizia, no? E invece, questo “ritorno alla normalità” può scatenare un inferno infiammatorio e un tipo particolare di morte cellulare chiamato ferroptosi, che può portare a conseguenze gravissime, persino fatali.
La ferroptosi è una forma di morte cellulare programmata un po’ diversa dalle altre che magari conoscete, come l’apoptosi. È caratterizzata dall’accumulo di ferro e di specie reattive dell’ossigeno (ROS) derivate dai lipidi, che mandano letteralmente in tilt le cellule. Pensatela come una sorta di “ruggine” cellulare che distrugge tutto. Capire come fermarla è una delle grandi sfide della medicina moderna, specialmente in contesti come il danno II/R.
Il Nemico Insidioso: Il Danno da Ischemia-Riperfusione Intestinale e la Ferroptosi
Il danno II/R non è uno scherzo. Può verificarsi in seguito a shock emorragici o settici, ustioni gravi, ma anche durante interventi chirurgici complessi come bypass cardiopolmonari o trapianti di intestino tenue. Il problema è che il danno non si limita all’intestino: può innescare una risposta infiammatoria sistemica che colpisce organi distanti come polmoni, fegato e reni. Nonostante la sua gravità, le opzioni terapeutiche efficaci sono ancora pochine, proprio perché i meccanismi alla base non sono del tutto chiari.
Recentemente, però, i riflettori si sono accesi sulla ferroptosi come uno dei principali colpevoli. Questa morte cellulare, guidata dal ferro, porta all’accumulo di perossidi lipidici, al consumo di glutatione (un antiossidante cruciale) e all’inattivazione di un enzima chiave, la glutatione perossidasi 4 (GPX4). Immaginate una catena di montaggio impazzita che produce sostanze tossiche senza sosta. Ecco, la ferroptosi è un po’ così.
Entrano in Scena gli Eroi: le Cellule Staminali Mesenchimali del Midollo Osseo (BMSC) e le Loro Vescicole
Ma non disperiamo! La natura spesso ci offre soluzioni sorprendenti. Avete mai sentito parlare delle cellule staminali mesenchimali del midollo osseo (BMSC)? Sono cellule incredibilmente versatili, famose per le loro capacità rigenerative e per la loro abilità nel modulare l’infiammazione. Sono già state studiate per un sacco di patologie, dalla guarigione ossea alle malattie autoimmuni.
Il bello è che le BMSC non devono per forza trasformarsi in nuove cellule intestinali per fare il loro lavoro. Gran parte del loro superpotere risiede nel loro “effetto paracrino”, cioè nella capacità di rilasciare molecole bioattive che influenzano le cellule circostanti. E qui entrano in gioco le vere protagoniste della nostra storia: le vescicole extracellulari (EVs), in particolare gli esosomi. Pensate alle EVs come a dei minuscoli “postini cellulari”, pacchetti pieni di istruzioni (mRNA, microRNA, proteine, lipidi) che le cellule si scambiano per comunicare. Quelle derivate dalle BMSC (BMSC-EVs) sembrano avere effetti terapeutici notevoli in diverse condizioni, inclusi i danni da ischemia-riperfusione.
La domanda che si sono posti i ricercatori, e che mi ha subito incuriosito, è stata: possono queste BMSC-EVs contrastare la ferroptosi nel danno II/R intestinale? E se sì, come diavolo fanno?
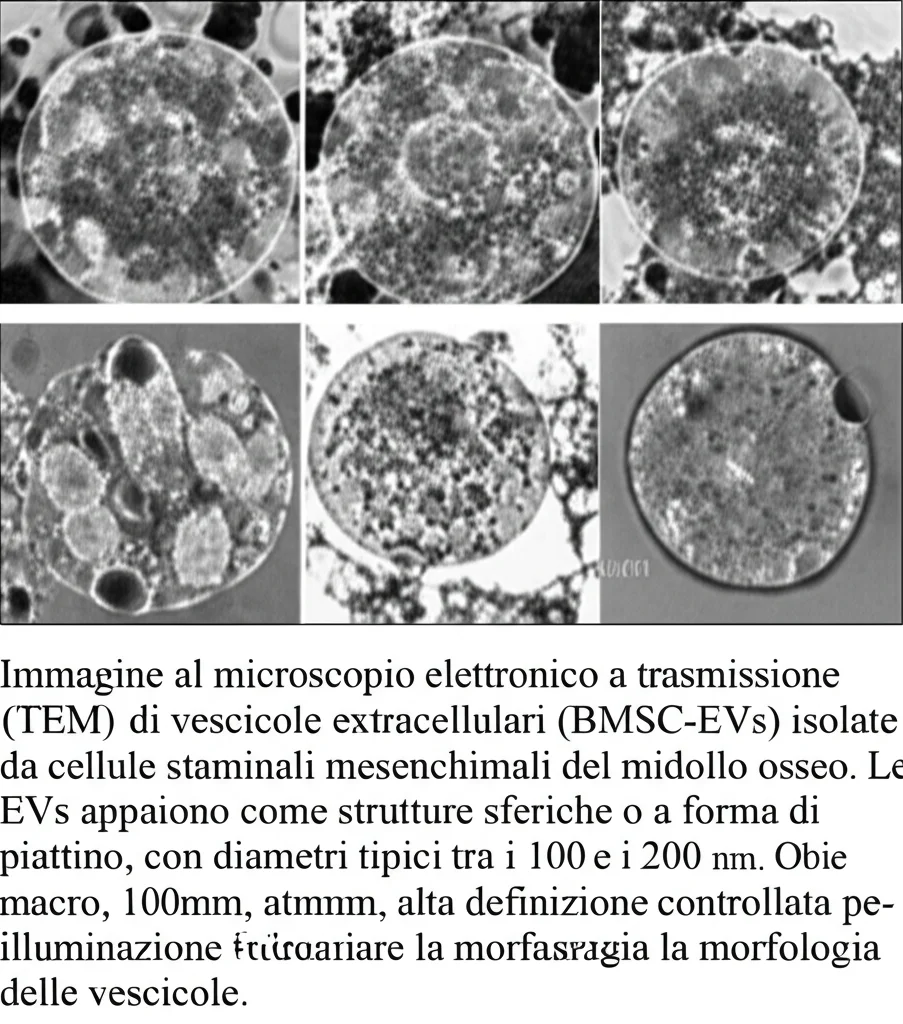
Per scoprirlo, gli scienziati hanno prima identificato i geni che “impazziscono” durante il danno II/R. Tra questi, due nomi sono saltati subito all’occhio perché già collegati alla ferroptosi: HMGB1 (High Mobility Group Box 1) e SREBF2 (Sterol Regulatory Element-Binding Transcription Factor 2). Esperimenti su modelli animali (topolini sottoposti a II/R intestinale) e su cellule intestinali umane (le Caco-2) coltivate in laboratorio e sottoposte a cicli di ipossia/riossigenazione (H/R) per mimare il danno, hanno confermato il loro coinvolgimento.
Svelare il Meccanismo: l’Asse SREBF2/HMGB1 e il Ruolo Chiave di un microRNA
Tenetevi forte, perché qui la faccenda si fa interessante. È emerso che HMGB1 è un attore chiave nella ferroptosi indotta da II/R. Se si “spegne” HMGB1, il danno intestinale e la ferroptosi si riducono. Ma chi controlla HMGB1? Ecco che entra in gioco SREBF2, un fattore di trascrizione che, come un direttore d’orchestra, regola l’espressione di HMGB1. In pratica, SREBF2 “accende” HMGB1, che a sua volta scatena la ferroptosi. Un vero e proprio asse del male cellulare!
E le BMSC-EVs? Beh, si è visto che queste vescicole sono in grado di alleviare la ferroptosi nelle cellule Caco-2 proprio sopprimendo l’asse SREBF2/HMGB1. Ma come? Qual è l’ingrediente segreto che trasportano?
La risposta è arrivata analizzando il contenuto delle BMSC-EVs, in particolare i microRNA (miRNA). I miRNA sono piccole molecole di RNA che non codificano per proteine, ma agiscono come dei “silenziatori” genici, regolando l’espressione di altri geni. Tra i vari miRNA presenti, uno in particolare ha attirato l’attenzione: miR-378a-3p. Si è scoperto che i livelli di questo miRNA calano drasticamente durante il danno II/R, ma sono abbondanti nelle BMSC-EVs.
L’ipotesi, poi confermata, è stata che le BMSC-EVs “consegnano” miR-378a-3p alle cellule intestinali danneggiate. E cosa fa questo miR-378a-3p una volta arrivato a destinazione? Modula l’asse SREBF2/HMGB1! Attenzione però, non lo fa direttamente legandosi a SREBF2, come si potrebbe pensare. La faccenda è un po’ più intricata (la biologia ama le sorprese!). miR-378a-3p agisce su un’altra proteina chiamata MAPK1, che a sua volta fa parte di una via di segnalazione (MAPK1/NF-κB) che controlla SREBF2. Quindi, inattivando MAPK1, miR-378a-3p riesce indirettamente a “calmare” SREBF2, riducendo di conseguenza HMGB1 e, voilà, la ferroptosi viene inibita!
- BMSC-EVs: i nostri “postini” pieni di speranza.
- miR-378a-3p: il “messaggio” cruciale contenuto nelle EVs.
- MAPK1/NF-κB: il primo bersaglio del messaggio.
- SREBF2: il “direttore d’orchestra” che viene calmato.
- HMGB1: l’esecutore della ferroptosi che viene disattivato.
- Ferroptosi: la “ruggine cellulare” che viene bloccata.
Le Prove del Nove: Esperimenti In Vivo e In Vitro
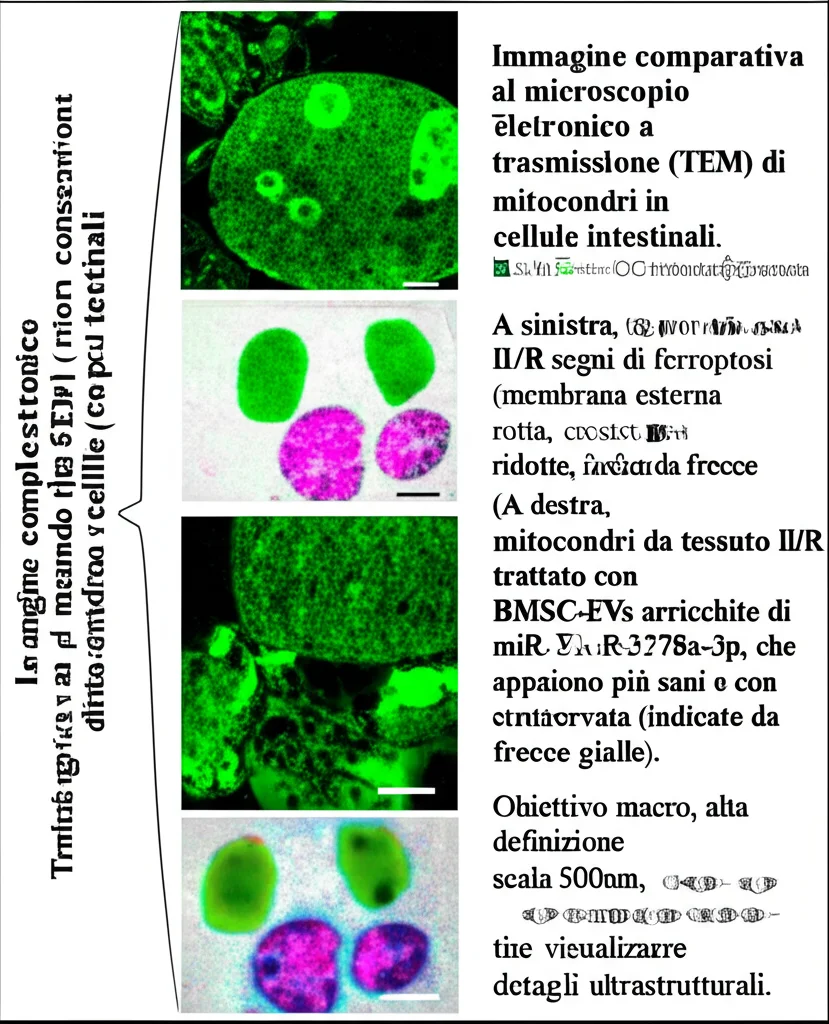
Per dimostrare tutto questo complesso meccanismo, i ricercatori hanno fatto un lavoro certosino. Hanno trattato i topolini con danno II/R con BMSC-EVs “arricchite” di miR-378a-3p. I risultati? Notevoli! Il danno alla mucosa intestinale si è ridotto, i marcatori di ferroptosi (come l’accumulo di ferro e di perossidi lipidici, e la riduzione di antiossidanti come il GSH e l’enzima GPX4) sono migliorati, e l’espressione di SREBF2, HMGB1 e MAPK1 è diminuita. Anche le immagini al microscopio elettronico hanno mostrato che i mitocondri (le centrali energetiche delle cellule, che nella ferroptosi si danneggiano pesantemente) erano in condizioni decisamente migliori.
Risultati simili sono stati ottenuti in vitro sulle cellule Caco-2. Quando queste cellule, sottoposte a ipossia/riossigenazione, venivano trattate con BMSC-EVs, la ferroptosi si attenuava. Se si inibiva miR-378a-3p nelle EVs, l’effetto protettivo diminuiva. Al contrario, se si aumentava la quantità di miR-378a-3p nelle EVs, l’effetto benefico era potenziato. Insomma, tutte le tessere del puzzle sembrano incastrarsi alla perfezione!
Cosa Significa Tutto Questo per il Futuro?
Beh, questa scoperta è davvero entusiasmante! Ci dice che le BMSC-EVs, e in particolare il loro carico di miR-378a-3p, rappresentano una strategia terapeutica potenzialmente molto promettente per contrastare il danno da ischemia-riperfusione intestinale e la ferroptosi. Invece di usare cellule intere, che possono avere qualche complessità in più, si potrebbero usare queste vescicole, che sono più “maneggevoli” e sembrano avere un buon profilo di sicurezza.
Certo, la strada dalla ricerca di base alla clinica è sempre lunga e piena di ostacoli, ma studi come questo aprono la porta a nuove possibilità. Immaginate di poter avere a disposizione un trattamento che, agendo su un meccanismo così specifico come l’asse miR-378a-3p/SREBF2/HMGB1, possa proteggere l’intestino (e forse anche altri organi) da questo tipo di danno devastante.
Io trovo che sia una prospettiva incredibilmente affascinante. La natura, ancora una volta, ci mostra la sua eleganza e complessità, e la scienza ci fornisce gli strumenti per decifrarla e, speriamo, per usarla a nostro vantaggio. Chissà quali altre meraviglie ci riserveranno questi minuscoli messaggeri cellulari!
Fonte: Springer