Cancro al Polmone: Come il VEGF Inganna la Terapia Combinata (Svelato dal scRNA-seq!)
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nella lotta contro il cancro al polmone non a piccole cellule (NSCLC), in particolare per quei pazienti che non presentano specifiche mutazioni genetiche “driver”. Sapete, le terapie neoadjuvanti, quelle fatte *prima* dell’intervento chirurgico, stanno cambiando le carte in tavola. In particolare, la combinazione di un farmaco chiamato anlotinib con l’immunoterapia basata sul blocco di PD-1 ha mostrato risultati promettenti, allungando la sopravvivenza di molti pazienti.
Però, c’è un “ma”. Non tutti i pazienti rispondono a questa combo terapeutica. E la domanda che ci siamo posti è: perché? Cosa succede a livello cellulare in chi non risponde? Per capirci qualcosa di più, abbiamo deciso di usare una tecnologia pazzesca chiamata sequenziamento dell’RNA a cellula singola, o scRNA-seq. Questa tecnica ci permette di spiare letteralmente cosa fanno le singole cellule – immunitarie, stromali (quelle di supporto) e tumorali – dentro il tumore, prima e dopo la terapia.
Lo Studio: Spiare le Cellule una per Una
Abbiamo analizzato i dati trascrittomici (cioè l’RNA espresso) di circa 47.000 singole cellule provenienti da 9 pazienti con NSCLC. Tre di questi non avevano ancora iniziato la terapia (li chiameremo “naïve” o TN), tre avevano avuto una risposta patologica maggiore (MPR) dopo la terapia (cioè avevano risposto alla grande), e tre invece non avevano avuto questa super risposta (Non-MPR).
Il regime terapeutico prevedeva 4 cicli di anlotinib (preso per bocca) combinato con camrelizumab (un inibitore di PD-1, dato per vena) ogni 3 settimane. Dopo questi cicli, se possibile, i pazienti venivano operati.
Analizzando questo mare di dati, abbiamo iniziato a vedere delle differenze nette tra chi rispondeva bene e chi no. Abbiamo identificato vari tipi cellulari: cellule epiteliali (incluse quelle tumorali), cellule endoteliali (quelle dei vasi sanguigni), fibroblasti, cellule T, cellule B, cellule muscolari lisce e cellule mieloidi (come i macrofagi).
Cosa Abbiamo Scoperto nei Pazienti che Rispondono Bene (MPR)
Nei pazienti MPR, la terapia combinata sembrava fare un ottimo lavoro nel “riprogrammare” il microambiente tumorale in senso positivo. Abbiamo notato che:
- L’espressione di geni associati all'”esaurimento” delle cellule T (quelle che combattono il tumore) diminuiva. In pratica, le cellule T erano meno stanche e più combattive.
- Si riduceva la trasformazione di un tipo particolare di cellule T (chiamate T_THEMIS) in cellule T regolatorie (Tregs). Le Tregs di solito spengono la risposta immunitaria, quindi meno Tregs è generalmente una buona cosa nella lotta al cancro.
- Si potenziava un “feedback positivo” tra le cellule T CD4+ e un tipo di cellule B della memoria (B4_PAX5+). Questa collaborazione tra cellule T e B sembrava rafforzare la risposta immunitaria contro il tumore. Abbiamo anche visto che una firma genica legata a queste cellule B della memoria (B4_PAX5) era associata a una prognosi migliore.
Insomma, nei pazienti MPR, la terapia sembrava risvegliare e coordinare meglio le difese immunitarie.
E Cosa Succede Quando la Terapia Non Funziona? (Non-MPR)
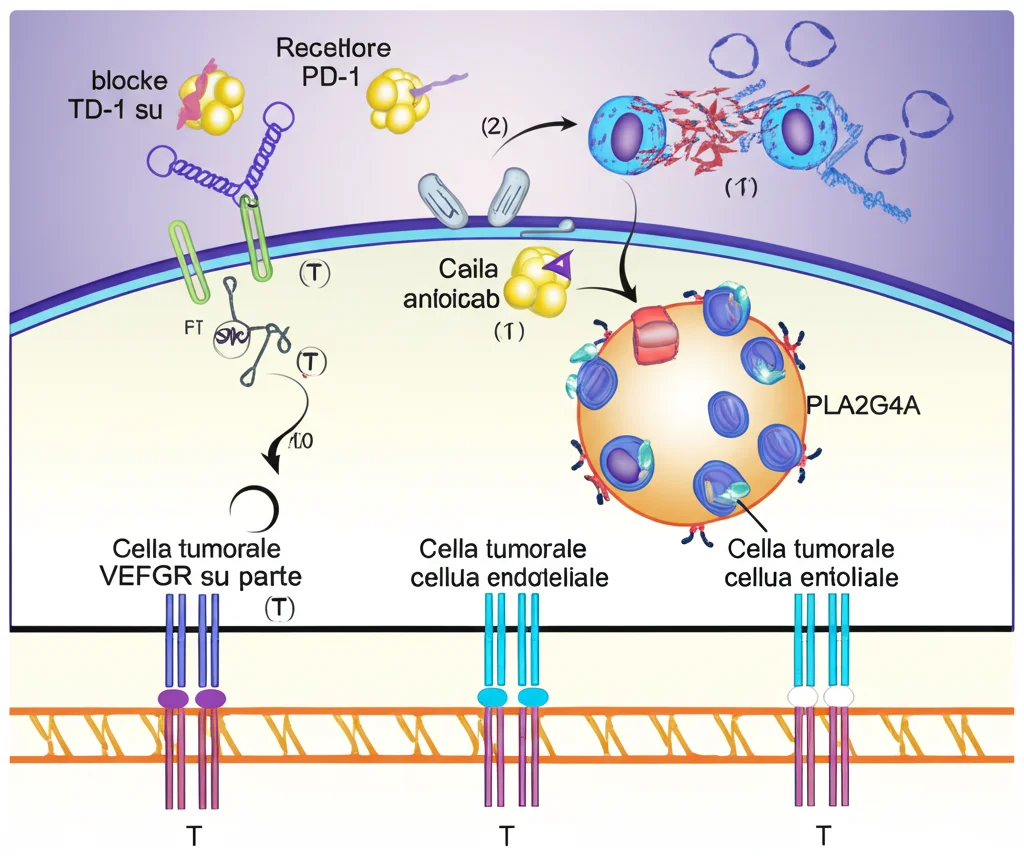
Qui le cose si complicano, e il protagonista sembra essere il signaling del VEGF. Il VEGF (Vascular Endothelial Growth Factor) è una molecola che stimola la crescita di nuovi vasi sanguigni (angiogenesi), un processo che il tumore sfrutta per crescere e diffondersi. Anlotinib è un inibitore dei recettori del VEGF (VEGFR), quindi dovrebbe bloccare questo processo. Ma nei pazienti Non-MPR, abbiamo visto che le cose non vanno proprio così lisce.
Ecco i punti chiave emersi nei pazienti Non-MPR:
- I macrofagi associati al tumore (TAMs) diventano dei veri e propri “hub” di comunicazione che smorzano l’efficacia della terapia. In particolare, un sottotipo chiamato Mac2_CD163L1, con caratteristiche immunosoppressive, aumentava significativamente in questi pazienti. Questi TAMs interagiscono fittamente con fibroblasti, cellule endoteliali e cellule tumorali, creando un ambiente ostile per le cellule immunitarie combattenti.
- TAMs e fibroblasti stimolano le cellule endoteliali attraverso il VEGF.
- Le cellule endoteliali sembrano “rispondere” all’anlotinib in modo controproducente. Abbiamo notato un aumento delle cellule endoteliali che esprimono FLT1 (un tipo di VEGFR). Sospettiamo che un fattore di trascrizione chiamato ZEB1 possa essere coinvolto nell’aumentare l’espressione di FLT1, rendendo le cellule endoteliali meno sensibili all’anlotinib o comunque contribuendo a un fenotipo immunoevasivo. Una firma genica associata a queste cellule endoteliali VEGFR+ è risultata predittiva di una sopravvivenza peggiore in un’analisi su dati pubblici (TCGA).
- Le stesse cellule tumorali non stanno a guardare. Abbiamo scoperto che un enzima chiave nella via del VEGF, chiamato PLA2G4A (o cPLA2), era altamente espresso nelle cellule tumorali dei pazienti Non-MPR *dopo* il trattamento con anlotinib. È come se il tumore, vedendosi bloccare una via (quella diretta del VEGF), ne attivasse un’altra per resistere.
PLA2G4A: Un Nuovo Attore nella Resistenza?
Questo PLA2G4A ci ha incuriosito molto. Abbiamo voluto verificare il suo ruolo in un gruppo più ampio di 135 pazienti con NSCLC, usando tecniche di immunoistochimica (che colorano le proteine nei tessuti). Ebbene, abbiamo confermato che alti livelli di PLA2G4A erano associati a una prognosi peggiore e, cosa interessante, a una maggiore infiltrazione di Tregs (le cellule immunosoppressive).
Questo suggerisce un meccanismo di resistenza complesso: l’anlotinib blocca il VEGFR, ma questo potrebbe indurre le cellule tumorali ad aumentare PLA2G4A. I prodotti di questo enzima (derivati dell’acido arachidonico) potrebbero poi favorire un microambiente immunosoppressivo, magari promuovendo l’arrivo o l’attivazione delle Tregs, vanificando così l’effetto dell’immunoterapia (il blocco di PD-1). Sembra che i TAMs possano fare da tramite in questo processo, magari usando segnali come SPP1 per influenzare la differenziazione delle cellule T_THEMIS verso le Tregs.
Implicazioni e Prospettive Future
Cosa ci dice tutto questo? Ci dice che la resistenza alla terapia combinata con anlotinib e blocco di PD-1 nel NSCLC è un fenomeno complesso, dove il signaling del VEGF gioca un ruolo centrale, ma non solo attraverso i suoi recettori diretti. I cambiamenti dinamici indotti dalla terapia stessa nelle cellule endoteliali (tramite ZEB1 e FLT1) e nelle cellule tumorali (tramite PLA2G4A) sono profondamente coinvolti nella creazione di un fenotipo resistente e immunosoppressivo.
Questo studio, anche se basato su un numero limitato di pazienti, apre nuove strade. Identificare pazienti con alta espressione di ZEB1 nelle cellule endoteliali o di PLA2G4A nelle cellule tumorali potrebbe aiutarci a predire chi non risponderà alla terapia combinata. Inoltre, PLA2G4A emerge come un potenziale bersaglio terapeutico. Certo, in passato gli inibitori di PLA2 hanno avuto fortune alterne negli studi clinici, spesso per mancanza di specificità o effetti collaterali. Ma capire meglio il ruolo specifico delle diverse isoforme di PLA2 nel cancro potrebbe portare allo sviluppo di inibitori più selettivi ed efficaci in futuro.
La tecnologia scRNA-seq si è dimostrata uno strumento potentissimo per svelare queste dinamiche complesse a livello della singola cellula, dandoci una visione senza precedenti di come il tumore e il suo microambiente si adattano e resistono alle terapie. È un passo avanti importante verso una medicina sempre più di precisione nella lotta contro il cancro al polmone.
Fonte: Springer