Mieloma Multiplo: Scoperto Come USP5 Alimenta un Ambiente Immuno-Soppressivo
Ciao a tutti! Oggi voglio parlarvi di una scoperta affascinante che getta nuova luce su un nemico ostico: il mieloma multiplo (MM). Si tratta di un tumore del sangue, una forma di cancro ematologico noto per la sua eterogeneità, le alte percentuali di recidiva e la difficoltà nel raggiungere una cura definitiva. Pensate che solo nel 2019 ci sono stati quasi 160.000 nuovi casi nel mondo!
Il Microambiente: Un Complice Nascosto nel Mieloma Multiplo
Una delle cose che rende il MM così complesso è che non si tratta solo delle cellule tumorali impazzite. C’è tutto un “quartiere” attorno a loro, il cosiddetto microambiente del midollo osseo (BMME), che gioca un ruolo fondamentale. Immaginatelo come un ecosistema complesso dove le cellule tumorali (le plasmacellule maligne) interagiscono con un sacco di altri attori: macrofagi, cellule T immunitarie, cellule stromali, osteoclasti… un vero e proprio cast di personaggi!
Il problema è che le cellule del mieloma sono brave a manipolare questo ambiente. Promuovono la formazione di un microambiente immuno-soppressivo, una sorta di scudo che non solo le aiuta a sopravvivere e proliferare, ma le protegge anche dalle terapie farmacologiche. Capite bene che svelare i meccanismi di questa interazione tra cellule tumorali e microambiente è cruciale per capire come si sviluppa il MM e, soprattutto, per trovare nuove strategie di diagnosi e cura.
L’Effetto Warburg e il Lattato: Carburante per il Tumore e Veleno per le Difese
Avete mai sentito parlare dell’effetto Warburg? È una caratteristica classica delle cellule tumorali. In pratica, anche in presenza di ossigeno, preferiscono “bruciare” glucosio attraverso un processo chiamato glicolisi, producendo energia in modo rapido ma meno efficiente, e generando un prodotto di scarto: il lattato.
Per molto tempo, il lattato è stato considerato solo “spazzatura metabolica”. Ma oggi sappiamo che è molto di più! Nei tumori, i livelli di lattato sono significativamente più alti che nei tessuti normali e questo acido lattico non è affatto inerte. Agisce come un vero e proprio messaggero, influenzando le cellule immunitarie. In particolare, contribuisce a creare quell’ambiente immuno-soppressivo di cui parlavamo prima. Come? Ad esempio, spingendo i macrofagi associati al tumore (TAM) a diventare di tipo “M2”. Questi macrofagi M2, invece di attaccare il tumore (come farebbero i “bravi” macrofagi M1), lo aiutano a crescere e a sfuggire alle difese immunitarie. Il lattato può anche spegnere la capacità delle cellule T di uccidere le cellule tumorali. Insomma, un vero sabotatore!
Nel mieloma multiplo, le cellule tumorali mostrano proprio queste caratteristiche: una glicolisi potenziata e un’aumentata produzione di lattato. Ma quali sono i meccanismi molecolari dietro a tutto questo e come influenzano specificamente i macrofagi nel microambiente del midollo osseo? Qui entra in gioco il protagonista della nostra storia: USP5.
USP5: Un Regista Inaspettato nel Dramma del Mieloma
USP5 (Ubiquitin-Specific Protease 5) appartiene a una famiglia di enzimi chiamati proteasi specifiche dell’ubiquitina. Cosa fanno? Immaginate che le proteine nelle nostre cellule abbiano delle “etichette” (l’ubiquitina) che ne determinano il destino: se devono essere degradate, dove devono andare, ecc. Gli enzimi USP rimuovono queste etichette, controllando così la stabilità e la funzione delle proteine. Sono fondamentali per un sacco di processi cellulari.
Studi precedenti avevano già suggerito che USP5 potesse essere importante nel mieloma multiplo. Si era visto che “spegnere” USP5 (tramite knockdown) poteva sopprimere la crescita delle cellule di MM e indurre la loro morte (apoptosi). Inoltre, ricerche recenti su altri tumori (cancro al seno triplo negativo, carcinoma epatocellulare) avevano collegato USP5 proprio alla glicolisi.
Quindi, ci siamo chiesti: e se USP5 fosse il pezzo mancante del puzzle nel mieloma multiplo? Se fosse proprio USP5 a regolare la glicolisi nelle cellule di MM, portando alla produzione di lattato e alla creazione di quel microambiente immuno-soppressivo che favorisce il tumore?
Le Nostre Scoperte: USP5 Tira le Fila
Per rispondere a questa domanda, abbiamo iniziato analizzando campioni di midollo osseo di pazienti con MM e donatori sani, oltre a diverse linee cellulari di mieloma. E la prima cosa che abbiamo notato è stata lampante: USP5 era significativamente sovraespresso sia nei pazienti che nelle linee cellulari tumorali rispetto ai controlli sani. Non solo, ma la sua espressione aumentava ulteriormente in condizioni di ipossia (carenza di ossigeno, tipica del microambiente tumorale) o quando le cellule di MM venivano coltivate insieme alle cellule stromali del midollo osseo. Questo ci ha confermato che USP5 era probabilmente coinvolto nella malattia.
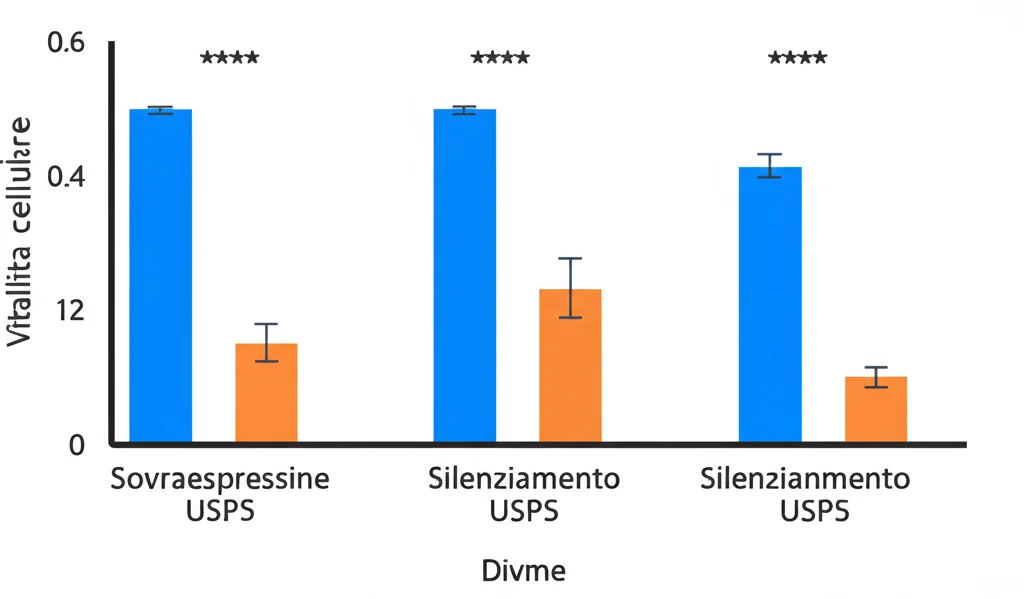
A questo punto, siamo passati all’azione. Abbiamo “silenziato” USP5 in alcune linee cellulari di MM e lo abbiamo “sovraespresso” in altre. I risultati sono stati netti:
- Silenziamento di USP5: Le cellule tumorali crescevano meno, andavano più facilmente incontro ad apoptosi (morte cellulare programmata), la loro attività glicolitica (consumo di glucosio, produzione di lattato e ATP) diminuiva drasticamente.
- Sovraespressione di USP5: Effetti opposti! Le cellule crescevano di più, morivano meno e la loro glicolisi era potenziata.
Quindi, sì, USP5 sembra proprio dare una bella spinta alla sopravvivenza e al metabolismo “zuccherino” delle cellule di mieloma.
Dalla Glicolisi all’Immuno-soppressione: Il Ruolo del Lattato
Ma torniamo al lattato e ai macrofagi. Se USP5 aumenta la glicolisi e quindi la produzione di lattato, questo dovrebbe influenzare i macrofagi, giusto? Per verificarlo, abbiamo fatto un esperimento chiave. Abbiamo preso il “brodo di coltura” (il mezzo condizionato dal tumore, TCM) delle cellule di MM con USP5 silenziato o sovraespresso e lo abbiamo usato per “trattare” dei macrofagi derivati da donatori sani. In alcuni casi, abbiamo anche aggiunto un inibitore della produzione di lattato (OXM).
I risultati? Eccome se c’era un effetto!
- Il TCM delle cellule con USP5 silenziato induceva meno macrofagi M2 (quelli “cattivi”, pro-tumorali). E se aggiungevamo l’inibitore del lattato (OXM), l’effetto era ancora più marcato.
- Il TCM delle cellule con USP5 sovraespresso, al contrario, spingeva i macrofagi verso il fenotipo M2. Ma se bloccavamo la produzione di lattato con OXM, questo effetto veniva annullato!
Questo ci ha dato la prova: USP5 promuove la polarizzazione dei macrofagi verso il tipo M2 immuno-soppressivo proprio attraverso l’aumento della glicolisi e la conseguente produzione di lattato. Non abbiamo visto cambiamenti significativi nei marcatori dei macrofagi M1 (quelli “buoni”).
Il Meccanismo Molecolare: Come Fa USP5? La Pista STAT2-PFKFB4
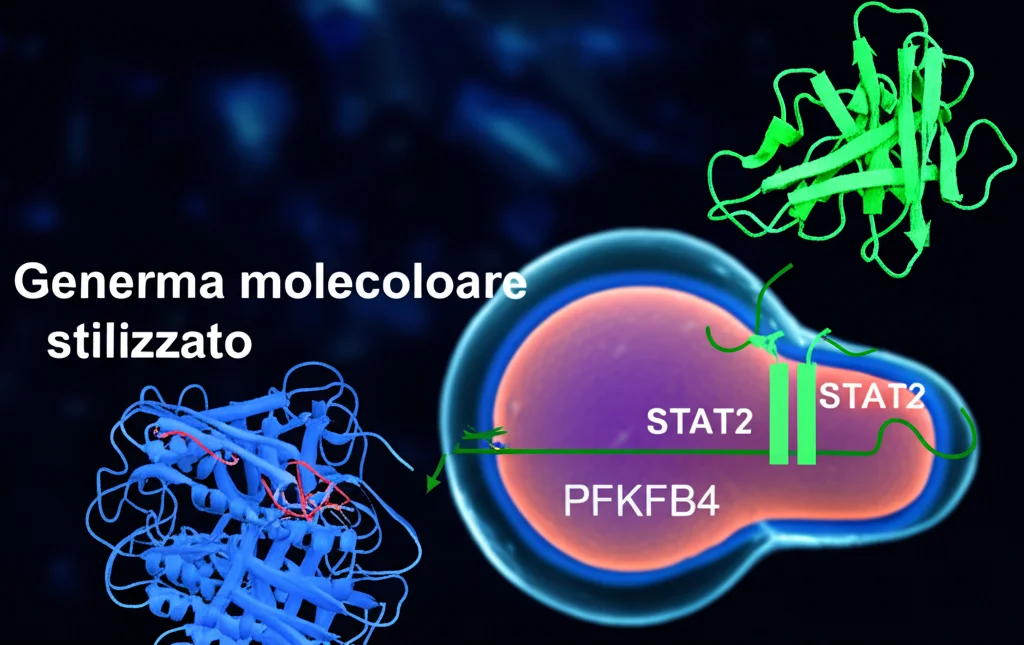
Ok, USP5 fa tutto questo, ma come? Qual è il meccanismo molecolare? Sapevamo che USP5 è un enzima deubiquitinante. Ci siamo messi a caccia dei suoi possibili bersagli proteici. Usando database predittivi e poi esperimenti di laboratorio (come la co-immunoprecipitazione e saggi di ubiquitinazione), abbiamo trovato un partner molecolare chiave: STAT2 (Signal Transducer and Activator of Transcription 2).
Abbiamo scoperto che USP5 interagisce direttamente con STAT2 e, rimuovendo le “etichette” di ubiquitina, ne impedisce la degradazione. In pratica, USP5 stabilizza la proteina STAT2. Quando USP5 è alto, c’è più STAT2 stabile nella cellula; quando USP5 è basso, STAT2 viene degradato più velocemente.
E cosa fa STAT2 una volta stabilizzato? STAT2 è un fattore di trascrizione, cioè una proteina che può “accendere” o “spegnere” altri geni. Analizzando ulteriormente, abbiamo scoperto che STAT2 si lega direttamente al promotore (l’interruttore) di un altro gene cruciale per la glicolisi: PFKFB4 (6-Phosphofructo-2-Kinase/Fructose-2,6-Biphosphatase 4). In breve, STAT2 attivato da USP5 accende la trascrizione di PFKFB4.
PFKFB4 è un enzima importantissimo che regola la velocità della glicolisi. Aumentare PFKFB4 significa dare gas al processo glicolitico.
La Prova del Nove: Riconnettere i Puntini
A questo punto, avevamo delineato un percorso: USP5 → stabilizza STAT2 → attiva PFKFB4 → aumenta la glicolisi → produce più lattato → promuove i macrofagi M2 immuno-soppressivi.
Per essere sicuri che fosse proprio questa la catena di eventi, abbiamo fatto degli esperimenti di “salvataggio”.
- Nelle cellule dove avevamo silenziato USP5 (e quindi visto meno crescita, meno glicolisi, meno M2), abbiamo provato a sovraesprimere artificialmente STAT2. Risultato? Gli effetti del silenziamento di USP5 venivano in gran parte annullati!
- Viceversa, nelle cellule dove avevamo sovraespresso USP5 (più crescita, più glicolisi, più M2), abbiamo provato a silenziare STAT2. Risultato? Gli effetti della sovraespressione di USP5 venivano significativamente ridotti!
Questo ci ha confermato che STAT2 è davvero un mediatore fondamentale degli effetti di USP5 sulla sopravvivenza cellulare, sulla glicolisi e sulla polarizzazione dei macrofagi nel mieloma multiplo.
Conferma In Vivo: Dai Tubi di Prova ai Topi
Infine, per essere certi che le nostre scoperte non fossero valide solo in laboratorio (in vitro), ma anche in un organismo complesso (in vivo), abbiamo usato un modello animale. Abbiamo iniettato cellule di mieloma (con USP5 normale o silenziato), mescolate con macrofagi, in topi immunodeficienti.
I risultati hanno confermato quanto visto in provetta: i topi che avevano ricevuto le cellule con USP5 silenziato sviluppavano tumori significativamente più piccoli. Analizzando questi tumori, abbiamo trovato livelli più bassi di USP5, STAT2 e PFKFB4, una ridotta espressione dei geni legati alla glicolisi e, cosa importante, una minore presenza di macrofagi M2 (identificati dalla co-localizzazione dei marcatori CD11b e CD206).
Conclusioni e Prospettive Future
Insomma, il nostro studio ha svelato un meccanismo piuttosto intricato ma affascinante: nel mieloma multiplo, la proteina USP5 agisce come un importante regolatore. Stabilizzando STAT2, attiva la trascrizione di PFKFB4, potenziando così la glicolisi nelle cellule tumorali. Questo porta a un’elevata produzione di lattato, che a sua volta contribuisce a creare un microambiente immuno-soppressivo, favorendo la formazione di macrofagi M2 che aiutano il tumore invece di combatterlo.
Questa scoperta non è solo interessante dal punto di vista biologico, ma apre anche nuove prospettive terapeutiche. Se USP5 è così cruciale per la sopravvivenza del mieloma e per la creazione del suo “scudo” immunitario, allora bloccare l’attività di USP5 potrebbe essere una strategia efficace per combattere questo tumore. Inibire USP5 potrebbe non solo colpire direttamente le cellule tumorali, ma anche “riprogrammare” il microambiente rendendolo meno ospitale per il cancro e più reattivo alle difese immunitarie.
Ovviamente, siamo ancora all’inizio, ma questi risultati forniscono una solida base teorica per sviluppare nuove terapie mirate contro il mieloma multiplo. La strada è ancora lunga, ma aver identificato un nuovo potenziale bersaglio come USP5 è un passo avanti importante nella lotta contro questa malattia. Speriamo che queste ricerche possano tradursi presto in nuove speranze per i pazienti!
Fonte: Springer