USP18: La Proteina Scudo che Difende il Tumore al Fegato dallo Stress e dalla Morte
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante che sta emergendo nel complesso mondo della ricerca sul cancro, in particolare riguardo all’epatocarcinoma (HCC), una delle forme tumorali più insidiose e, purtroppo, comuni. Immaginate le cellule tumorali come piccoli soldati ribelli che cercano in tutti i modi di sopravvivere e proliferare. Bene, sembra che abbiano degli alleati interni molto potenti, e uno di questi si chiama USP18.
Cos’è l’Epatocarcinoma e Perché è un Problema Serio?
Prima di tuffarci nei meandri molecolari, un piccolo passo indietro. L’epatocarcinoma è un tumore primario del fegato, e i numeri parlano chiaro: secondo i dati GLOBOCAN 2020, è responsabile di oltre 830.000 decessi all’anno nel mondo. Nonostante i progressi nelle terapie tradizionali (chirurgia, trapianto, chemioembolizzazione) e l’avvento di terapie mirate e immunoterapia (come gli inibitori dei checkpoint PD-1/PD-L1), la battaglia è ancora lunga. L’efficacia varia da paziente a paziente e gli effetti collaterali possono essere pesanti. Ecco perché capire i meccanismi molecolari alla base della sua crescita è fondamentale per trovare nuove armi.
Entra in Scena USP18: Un Enzima Deubiquitinante con un Ruolo Ambiguo
Ed è qui che entra in gioco la nostra protagonista: USP18, che sta per Ubiquitin-specific peptidase 18. Fa parte della famiglia delle peptidasi specifiche per l’ubiquitina (USPs), enzimi cruciali che “puliscono” le proteine rimuovendo piccole etichette molecolari chiamate ubiquitina (o, nel caso specifico di USP18, una proteina simile chiamata ISG15). Questo processo, chiamato deubiquitinazione, è fondamentale perché regola la stabilità delle proteine, la trasduzione dei segnali e molti altri processi cellulari.
Studi precedenti hanno mostrato che USP18 è spesso “sovraespresso”, cioè presente in quantità maggiori del normale, in diversi tipi di tumore, tra cui quello al fegato. E indovinate un po’? Dati provenienti da database come UALCAN, KM-plotter e HPA, che analizzano l’espressione genica nei tumori umani, suggeriscono che alti livelli di USP18 nell’epatocarcinoma sono associati a una prognosi peggiore per i pazienti. Questo ci ha fatto drizzare le antenne: USP18 potrebbe essere un fattore che aiuta il tumore a crescere e resistere. In effetti, abbiamo visto che le linee cellulari di epatocarcinoma (come SMMC-7721, Bel-7402, HepG2, Huh7) esprimono livelli significativamente più alti di USP18 rispetto alle cellule normali del fegato (LO2).
USP18 Mette i Freni all’Apoptosi: La Via Mitocondriale
Uno dei modi principali in cui le cellule “difettose” o danneggiate vengono eliminate è attraverso un processo di suicidio programmato chiamato apoptosi. È un meccanismo di controllo qualità essenziale. Se le cellule tumorali riescono a bloccare l’apoptosi, possono continuare a proliferare indisturbate.
Abbiamo quindi indagato se USP18 avesse un ruolo in questo. Utilizzando linee cellulari di HCC (Huh7 e SMMC7721), abbiamo “silenziato” il gene USP18 (usando piccoli RNA interferenti, siUSP18) o lo abbiamo “sovraespresso” (usando plasmidi). I risultati sono stati chiari:
- Quando abbiamo ridotto USP18, la proliferazione delle cellule tumorali è diminuita e l’apoptosi è aumentata.
- Quando abbiamo aumentato USP18, la proliferazione è aumentata e l’apoptosi è diminuita.
Analizzando le proteine coinvolte nella via classica dell’apoptosi, quella “mitocondriale”, abbiamo visto che riducendo USP18 diminuiva la proteina anti-apoptotica Bcl-2 e aumentavano le proteine pro-apoptotiche come Bax, Citocromo C (Cyto-C) e la forma attiva della Caspasi-3 (un “boia” molecolare che esegue l’apoptosi). Il contrario accadeva sovraesprimendo USP18. Quindi, un primo meccanismo è chiaro: USP18 agisce come un freno sull’apoptosi mitocondriale, favorendo la sopravvivenza delle cellule tumorali.

Non Solo Mitocondri: USP18 e lo Stress del Reticolo Endoplasmatico (ER)
Ma l’apoptosi non passa solo dai mitocondri. C’è un’altra via importante, legata a un organello cellulare chiamato Reticolo Endoplasmatico (ER). Immaginate l’ER come una fabbrica super efficiente che produce e ripiega correttamente le proteine. A volte, però, a causa di vari fattori (carenza di nutrienti, ischemia, accumulo di proteine difettose), questa fabbrica va in tilt. Si accumulano proteine mal ripiegate, e questo causa uno stato di “stress” detto, appunto, stress del Reticolo Endoplasmatico (ER stress).
Inizialmente, la cellula cerca di risolvere il problema attivando una serie di risposte adattative note come Unfolded Protein Response (UPR). Ma se lo stress è troppo forte o prolungato, la UPR stessa può innescare l’apoptosi per eliminare la cellula ormai compromessa. Nelle cellule tumorali, la gestione dello stress ER è cruciale: devono tollerarlo per sopravvivere, ma senza arrivare al punto di autodistruggersi.
USP18 Agisce Anche sulla Via dello Stress ER
Qui le cose si fanno ancora più interessanti. In uno studio precedente, avevamo notato che silenziando USP18 in cellule di epatoblastoma (HepG2.2.15), aumentava l’espressione di geni legati allo stress ER, come CHOP (una proteina chiave che promuove l’apoptosi indotta da stress ER) e GRP78 (un marcatore generale dello stress ER). Questo ci ha suggerito che USP18 potesse avere un ruolo anche in questa via.
Nel nostro studio più recente, abbiamo confermato questa ipotesi. Abbiamo trattato le cellule Huh7 con:
- Un inibitore dello stress ER (4-PBA): come previsto, riduceva l’apoptosi. Ma se contemporaneamente silenziavamo USP18, l’effetto protettivo del 4-PBA veniva parzialmente annullato, indicando che USP18 normalmente aiuta a *contrastare* lo stress ER.
- Un attivatore dello stress ER (Tunicamicina, TM): come previsto, aumentava l’apoptosi. Ma se contemporaneamente sovraesprimevamo USP18, l’effetto pro-apoptotico della TM veniva parzialmente contrastato, indicando che USP18 *protegge* dallo stress ER.
Analizzando le proteine, abbiamo visto che manipolare USP18 influenzava significativamente i livelli di CHOP e della Caspasi-3 attiva, ma non quelli di GRP78 (suggerendo un’azione più specifica a valle). L’immunofluorescenza ha confermato visivamente che USP18 e CHOP avevano livelli inversamente correlati in queste condizioni.
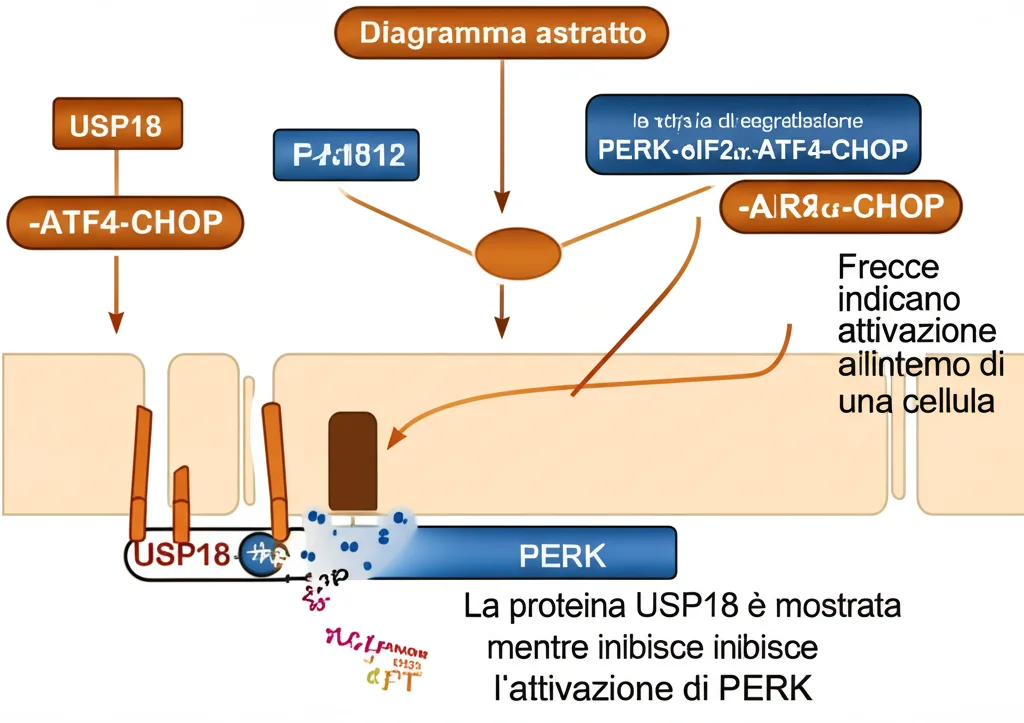
Svelato il Meccanismo: L’Asse PERK-eIF2α-ATF4
La UPR ha tre “bracci” principali di segnalazione. Ci siamo chiesti quale fosse influenzato da USP18. Analizzando le proteine chiave di questi percorsi (IRE1α, ATF6, PERK), abbiamo scoperto che sovraesprimere USP18 inibiva la fosforilazione (cioè l’attivazione) di PERK, una delle chinasi iniziali della UPR, ma non sembrava avere effetti significativi su ATF6 o XBP-1s (un marcatore dell’attivazione di IRE1α).
PERK attivato normalmente fosforila eIF2α, che a sua volta promuove la traduzione del fattore di trascrizione ATF4. ATF4, infine, induce l’espressione di CHOP, portando all’apoptosi. Il nostro sospetto era che USP18 agisse proprio su questo asse: PERK → eIF2α → ATF4 → CHOP.
Per confermarlo, abbiamo usato un attivatore specifico di PERK (CCT020312). Come previsto, questo farmaco aumentava i livelli di p-PERK, p-eIF2α, ATF4 e CHOP. Ma, cosa cruciale, se le cellule sovraesprimevano USP18, l’effetto dell’attivatore di PERK su questi marcatori veniva significativamente ridotto!
Conclusioni: USP18, un Bersaglio Promettente?
Quindi, cosa ci dice tutto questo? Sembra proprio che USP18 sia un giocatore chiave nella sopravvivenza delle cellule di epatocarcinoma, agendo su due fronti principali:
- Inibisce la via apoptotica classica mitocondriale (regolando Bcl-2/Bax).
- Attenua lo stress del Reticolo Endoplasmatico e la conseguente apoptosi, specificamente inibendo l’asse PERK-eIF2α-ATF4-CHOP della UPR.
In pratica, USP18 aiuta le cellule tumorali a resistere sia ai segnali di morte interni “classici” sia a quelli derivanti dallo stress ambientale della “fabbrica” cellulare. Questo lo rende un bersaglio terapeutico potenzialmente molto interessante. Inibire USP18 potrebbe, in teoria, rendere le cellule tumorali più vulnerabili all’apoptosi, sia spontaneamente sia in risposta a terapie che inducono stress (come alcune chemioterapie).
Certo, la strada è ancora lunga. Bisogna capire esattamente *come* USP18 interagisce con PERK (è un’interazione diretta? Indiretta?) e quali potrebbero essere gli effetti collaterali di un suo blocco in tessuti sani. Ma questi risultati aprono nuove, eccitanti prospettive nella lotta contro l’epatocarcinoma. È affascinante vedere come, svelando questi intricati meccanismi molecolari, ci avviciniamo sempre di più a strategie terapeutiche più mirate ed efficaci!
Fonte: Springer