Ufd4: Svelato il Segreto delle Catene di Ubiquitina Ramificate K29/K48!
Ciao a tutti, appassionati di scienza e misteri cellulari! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico delle nostre cellule, per scoprire i segreti di un processo fondamentale chiamato ubiquitinazione. Pensatela come un sistema di etichettatura super sofisticato che le cellule usano per decidere il destino delle proteine: se devono essere degradate, spostate, o se devono interagire con altre compagne. Un vero e proprio codice a barre molecolare!
Al centro di questo sistema ci sono delle piccole proteine chiamate ubiquitina (Ub) che vengono attaccate ad altre proteine bersaglio. Ma la cosa si fa ancora più interessante: spesso non basta una singola ubiquitina, ma se ne legano tante a formare delle catene, dette di poliubiquitina. E come se non bastasse, queste catene possono avere diverse “forme” o “legami”, a seconda di quale lisina (un amminoacido) sulla superficie dell’ubiquitina precedente viene usata per attaccare la successiva. Ogni tipo di catena è un segnale diverso. Un po’ come dire che non tutte le etichette sono uguali!
Il Mistero delle Catene Ramificate K29/K48
Tra le varie etichette, quelle legate alla lisina 48 (K48) sono le più note per segnare una proteina per la “rottamazione”, cioè per la degradazione da parte del proteasoma, il macchinario cellulare di smaltimento. Ma la natura, si sa, ama la complessità e l’efficienza. Così, si è scoperto che queste catene K48 possono essere ulteriormente modificate, con l’aggiunta di altre ubiquitine legate in posizioni diverse, come la lisina 29 (K29), formando delle strutture ramificate K29/K48. Immaginate un albero: il tronco è la catena K48 e i rami sono i legami K29. Queste catene ramificate sembrano essere un segnale di degradazione “potenziato”, una sorta di “URGENTE, DA DISTRUGGERE SUBITO!”.
Ma come diavolo fanno le cellule a costruire queste strutture così specifiche e complesse? Qui entra in gioco la nostra protagonista di oggi: un enzima E3 ligasi di tipo HECT chiamato Ufd4. Nel lievito (il nostro modello di studio preferito per capire i meccanismi base della vita), Ufd4 lavora in coppia con un’altra E3 ligasi, Ubr1. Mentre Ubr1 inizia ad attaccare le catene K48, Ufd4 interviene per “decorarle” con legami K29, creando appunto queste super-catene ramificate. Il problema è che, fino a poco tempo fa, non sapevamo esattamente come Ufd4 facesse questo lavoro di fino.
Spiare Ufd4 in Azione: La Magia della Crio-EM
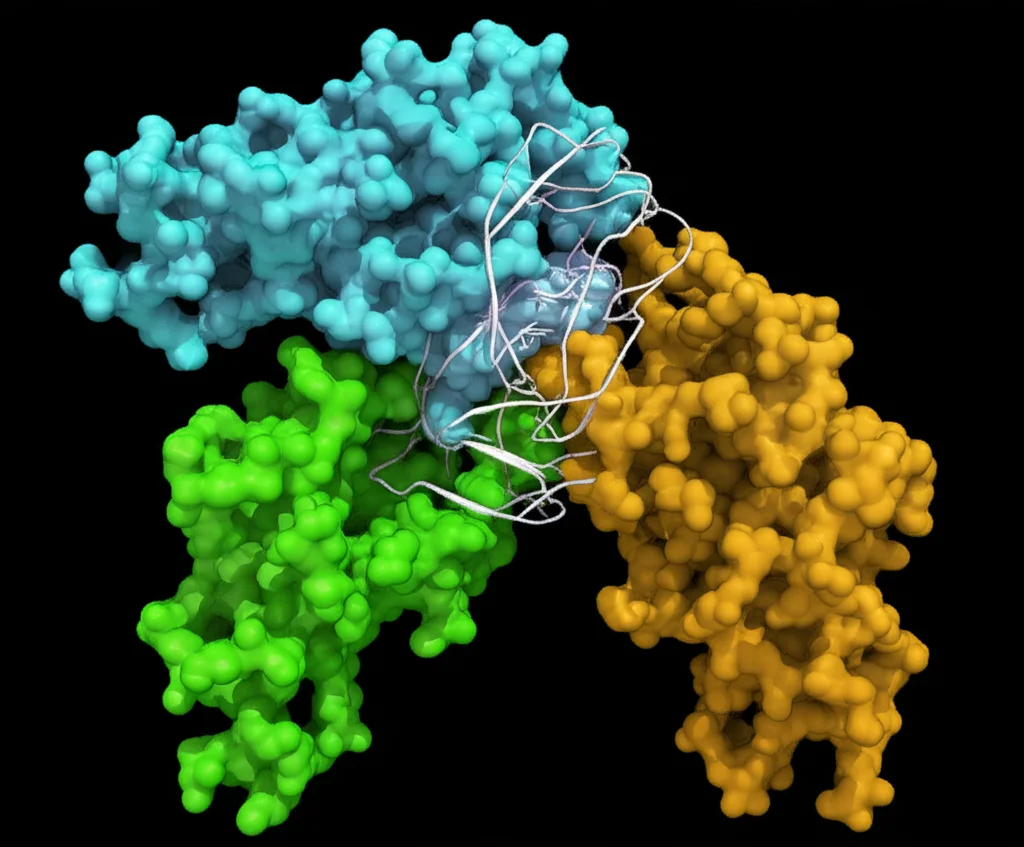
Ed è qui che la scienza si fa davvero entusiasmante! Utilizzando tecniche biochimiche sofisticate e, soprattutto, la crio-microscopia elettronica (crio-EM) – una sorta di macchina fotografica molecolare potentissima – siamo riusciti a “spiare” Ufd4 mentre è all’opera. Immaginate di poter fare delle istantanee di una macchina complessa mentre sta assemblando un pezzo, vedendo ogni ingranaggio muoversi! È un po’ quello che abbiamo fatto.
Abbiamo scoperto che Ufd4 ha una preferenza netta: adora lavorare su catene di ubiquitina K48 già formate. Non parte da zero, ma modifica quello che c’è già. E, cosa ancora più precisa, attacca la nuova ubiquitina (formando il legame K29) preferenzialmente sull’ubiquitina prossimale della catena K48 preesistente. Per capirci, se la catena K48 è fatta di due ubiquitine, Ufd4 lavora su quella più vicina al punto di attacco originale.
Le immagini ottenute con la crio-EM ci hanno mostrato la struttura di Ufd4 in dettaglio mentre “abbraccia” la catena di ubiquitina K48 e si prepara a trasferirvi un’altra ubiquitina (che ha precedentemente “caricato” su di sé). Due regioni di Ufd4 sono cruciali per questo riconoscimento e posizionamento: una regione N-terminale chiamata ARM (che sta per armadillo-like, per la sua forma che ricorda le placche dell’armadillo, simpatico no?) e il lobo C del dominio HECT (il cuore catalitico dell’enzima). Insieme, queste due parti di Ufd4 agiscono come una pinza che afferra la catena K48 e orienta la lisina 29 del suo “primo” anello di ubiquitina proprio verso il sito attivo di Ufd4, dove l’ubiquitina “donatrice” è pronta per essere trasferita. È un balletto molecolare di una precisione incredibile!

Queste strutture ci hanno fornito, per la prima volta, una visualizzazione chiara di come un enzima E3 di tipo HECT costruisca una catena di ubiquitina ramificata. È come aver trovato il manuale d’istruzioni di un meccanismo cellulare importantissimo!
Non Solo Lievito: Una Storia Conservata nell’Evoluzione con TRIP12
Qualcuno potrebbe dire: “Ok, interessante, ma questo succede nel lievito. E noi umani?”. Bella domanda! La cosa ancora più affascinante è che questo meccanismo è conservato nell’evoluzione. L’omologo umano di Ufd4 si chiama TRIP12. E indovinate un po’? Abbiamo scoperto che anche TRIP12 preferisce le catene K48 e ci attacca sopra legami K29, formando le stesse catene ramificate K29/K48. Addirittura, la struttura di TRIP12 mentre fa questo lavoro è incredibilmente simile a quella di Ufd4!
Questo è super importante perché TRIP12 è implicato in processi cellulari umani, inclusa la degradazione di proteine indotta da farmaci innovativi chiamati PROTAC. I PROTAC sono molecole che agiscono come “pontieri”, portando una proteina E3 ligasi (come TRIP12 o altre) vicino a una proteina bersaglio che si vuole eliminare. Capire come TRIP12 aggiunge queste catene ramificate K29/K48 potrebbe aiutarci a disegnare PROTAC ancora più efficaci.
Il Passaggio di Testimone: Come Ufd4 Prende l’Ubiquitina
Ma c’è un altro pezzo del puzzle. Prima che Ufd4 (o TRIP12) possa attaccare l’ubiquitina al substrato, deve essa stessa “caricarsi” con un’ubiquitina. Questo avviene attraverso un passaggio di testimone da un altro enzima, chiamato E2 (nel nostro caso, Ubc4 per Ufd4). Siamo riusciti a “fotografare” anche questo momento cruciale!
Abbiamo visto come Ufd4 interagisce con Ubc4, che porta l’ubiquitina attivata. Il dominio HECT di Ufd4 si dispone in una conformazione specifica per “strappare” l’ubiquitina da Ubc4 e legarla temporaneamente al proprio sito attivo (una cisteina catalitica). È interessante notare che alcune parti di Ufd4, come il lobo C del dominio HECT, che interagiscono con Ubc4 durante questa fase di “caricamento”, sono le stesse che poi interagiranno con la catena di ubiquitina K48 substrato durante la fase di “ramificazione”. Questo implica che Ubc4 deve staccarsi e il lobo C deve riorientarsi per fare spazio al substrato. Un vero e proprio cambio di partner e di posizione!
Perché Tutto Questo è Importante?
Capire i dettagli di come Ufd4 e TRIP12 costruiscono queste catene di poliubiquitina ramificate K29/K48 non è solo una curiosità accademica. Queste catene sono segnali di degradazione potenziati, cruciali per eliminare proteine danneggiate o non più necessarie, come nel caso della via di degradazione “N-end rule” (che riconosce specifici amminoacidi all’inizio delle proteine come segnali di instabilità).
I nostri studi hanno anche messo in luce un aspetto sempre più riconosciuto: il ruolo delle regioni non catalitiche degli enzimi. La regione ARM di Ufd4/TRIP12, pur non essendo direttamente coinvolta nella reazione chimica, è fondamentale per riconoscere e posizionare correttamente il substrato. Questo ci dice che per capire veramente come funzionano questi macchinari molecolari, dobbiamo guardare l’enzima nella sua interezza, non solo al suo “motore” catalitico.
Inoltre, abbiamo osservato che per formare catene ramificate su una di-ubiquitina K48, Ufd4/TRIP12 ha bisogno di riconoscere entrambe le ubiquitine della catena K48, non solo quella distale (più lontana) come avviene spesso per l’allungamento di catene omotipiche (cioè fatte tutte dello stesso tipo di legame). Questo suggerisce una logica di riconoscimento più complessa per la formazione di ramificazioni.

Conclusioni e Prospettive Future
Insomma, quello che abbiamo scoperto è un tassello fondamentale per comprendere la grammatica del “codice ubiquitina”. Abbiamo svelato i dettagli strutturali di come Ufd4 e il suo omologo umano TRIP12 accettano l’ubiquitina e la trasferiscono per formare queste peculiari catene K29/K48-ramificate. È un meccanismo elegante e preciso, conservato attraverso l’evoluzione, che sottolinea l’importanza di queste modificazioni per la vita della cellula.
Certo, il lavoro non finisce qui. Ci sono ancora tante domande aperte. Altre ligasi E3 formano catene ramificate? Usano meccanismi simili o completamente diversi? E come fanno esattamente queste catene ramificate a potenziare il segnale di degradazione a livello del proteasoma? Sono tutte domande che ci terranno impegnati nei prossimi anni, continuando a esplorare questo affascinante universo molecolare che brulica dentro ognuno di noi.
Spero che questo piccolo tuffo nel mondo dell’ubiquitinazione vi abbia incuriosito. È incredibile pensare a quanta complessità e precisione ci sia dietro processi che, fino a qualche decennio fa, erano completamente sconosciuti. La scienza è davvero un’avventura continua!
Fonte: Springer