Tumore Osseo a Cellule Giganti: Chirurgia, Denosumab e i Segreti della Diagnosi Moderna
Ciao a tutti! Oggi voglio parlarvi di un argomento che mi affascina molto nel campo dell’oncologia ortopedica: il tumore a cellule giganti dell’osso, o GCTB per gli amici anglofoni (Giant Cell Tumor of Bone). Non è frequentissimo, rappresenta circa il 5% dei tumori ossei primari, ma quando si presenta, sa essere piuttosto aggressivo a livello locale. Colpisce soprattutto giovani adulti, tra i 20 e i 45 anni, e ha una predilezione per alcune zone specifiche come il ginocchio (femore distale, tibia prossimale), il polso (radio distale) e la spalla (omero prossimale).
Anche se di solito è benigno, la sua aggressività può portare a una distruzione ossea considerevole e, in rari casi, può dare metastasi, tipicamente ai polmoni. Immaginate una lesione che “mangia” l’osso dall’interno, senza margini netti e sclerotici, che a volte assottiglia o addirittura rompe la corticale ossea, espandendosi nei tessuti molli circostanti. A complicare le cose, circa il 30% dei GCTB presenta aree simili a cisti aneurismatiche, rendendo la diagnosi radiologica e istologica un po’ più insidiosa.
La Diagnosi: Tra Classificazione Storica e Marcatori Molecolari
Per decenni, noi medici ci siamo affidati alla classificazione radiografica di Campanacci. È un sistema a gradi (1, 2, 3) che valuta l’aspetto della lesione alle radiografie (margini, distruzione ossea, integrità della corticale, coinvolgimento dei tessuti molli) ed è stato fondamentale per guidare le scelte chirurgiche e prevedere la prognosi. E sapete una cosa? È ancora incredibilmente utile! Nel nostro studio retrospettivo su 55 pazienti, abbiamo visto come i tumori di grado 3 fossero significativamente più grandi dei gradi 1 e 2.
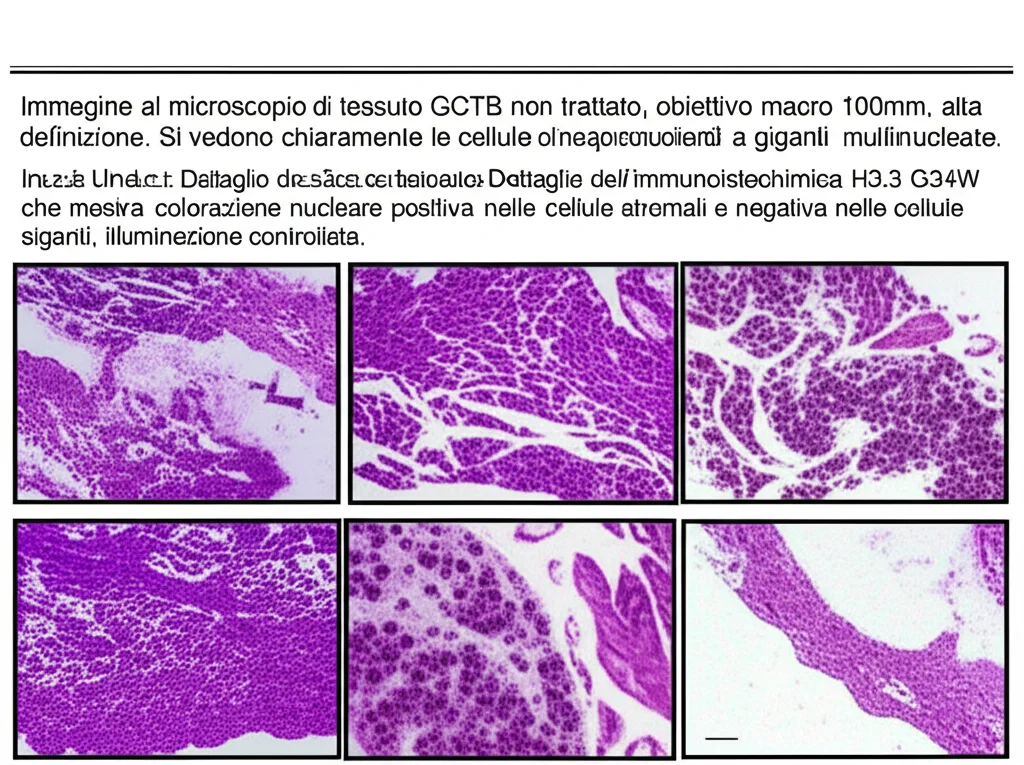
Ma la scienza non si ferma mai, vero? Negli ultimi anni, abbiamo fatto passi da gigante nella comprensione biologica del GCTB. Abbiamo scoperto che la stragrande maggioranza di questi tumori presenta una specifica mutazione nel gene H3F3A, in particolare la H3.3 G34W. La cosa fantastica è che ora possiamo rilevarla con un’analisi immunoistochimica, usando un anticorpo specifico (anti-H3.3 G34W). Questo test è diventato quasi di routine perché è super specifico e ci aiuta a distinguere il GCTB da altre lesioni ossee ricche di cellule giganti che possono assomigliargli. Nel nostro studio, tutti i tumori testati (26 casi) sono risultati positivi per H3.3 G34W! E l’analisi molecolare con tecniche avanzate come il Next-Generation Sequencing (NGS) ha confermato la mutazione H3F3A G34W in tutti gli 8 casi in cui è stata eseguita. Questi strumenti molecolari non solo confermano la diagnosi, ma aprono spiragli per capire meglio la prognosi.
Il Trattamento: Chirurgia al Centro, con un Aiuto Mirato
La pietra angolare del trattamento del GCTB resta la chirurgia. Le opzioni principali sono due:
- Curettage: In pratica, si “raschia via” il tumore dall’interno dell’osso, cercando di essere il più radicali possibile. Spesso si associa a terapie adiuvanti locali (come fenolo, azoto liquido o argon beam) per cercare di uccidere eventuali cellule tumorali residue e si riempie la cavità con cemento osseo (PMMA) o innesti ossei.
- Resezione in blocco: Si rimuove l’intero segmento osseo contenente il tumore. È un intervento più demolitivo, spesso necessario per tumori molto grandi, aggressivi o in sedi difficili, e richiede una ricostruzione complessa (protesi, innesti massivi).
La scelta dipende dalle dimensioni, dalla localizzazione e dall’aggressività del tumore (e qui torna utile la classificazione di Campanacci!). Il problema principale, soprattutto dopo il curettage, è il rischio di recidiva locale, che in alcune casistiche può arrivare anche al 50%. Nel nostro gruppo di pazienti, abbiamo osservato un tasso di recidiva del 32% dopo curettage e del 18% dopo resezione in blocco. Non una differenza statisticamente significativa nel nostro campione, ma comunque un dato su cui riflettere.
Ed è qui che entra in gioco un farmaco relativamente nuovo e molto interessante: il denosumab. Si tratta di un anticorpo monoclonale che blocca il RANKL, una molecola chiave che le cellule tumorali del GCTB usano per “reclutare” e attivare le cellule giganti che distruggono l’osso. Bloccando questo segnale, il denosumab riduce l’attività delle cellule giganti, porta alla formazione di nuovo osso all’interno della lesione e spesso ne riduce le dimensioni.
Denosumab: Quando e Perché?
Il denosumab non è una cura definitiva da solo, ma è diventato un prezioso strumento adiuvante, soprattutto nei casi considerati “ad alto rischio” o difficilmente operabili. Cosa intendiamo per alto rischio? Tumori molto grandi (> 8 cm), localizzati in zone critiche dove una resezione comporterebbe un grave deficit funzionale (ad esempio vicino a un’articolazione importante o nella colonna vertebrale), o tumori che hanno già distrutto la corticale ossea e si sono espansi nei tessuti molli.
Nel nostro studio, 9 pazienti su 55 hanno ricevuto denosumab, in media per circa 14-15 mesi. In 7 di questi 9 pazienti, il farmaco ha facilitato l’intervento chirurgico, riducendo le dimensioni del tumore o calcificandone i margini, rendendo il curettage più sicuro ed efficace. In un caso particolarmente complesso, ha permesso di evitare l’amputazione grazie a una notevole riduzione di volume di una lesione enorme nel femore! Abbiamo anche osservato, nei campioni chirurgici post-denosumab, una netta riduzione delle cellule giganti e un aumento della matrice ossea neoformata, anche se le cellule stromali neoplastiche (quelle che esprimono H3.3 G34W) sopravvivono alla terapia.

Certo, ci sono anche aspetti da considerare. Il denosumab non elimina il rischio di recidiva dopo la sospensione (due dei nostri pazienti trattati hanno avuto una recidiva locale), e la formazione di osso denso all’interno della lesione può rendere più difficile identificare microscopicamente eventuali residui tumorali durante l’intervento. Inoltre, sebbene nel nostro gruppo non abbiamo osservato effetti collaterali gravi come l’osteonecrosi della mandibola (ONJ) o l’ipocalcemia, è fondamentale un attento monitoraggio e una consulenza odontoiatrica preventiva.
Guardando al Futuro: Verso una Gestione Personalizzata
Cosa ci insegna tutto questo? Che la gestione del GCTB sta diventando sempre più un approccio multimodale e personalizzato. La chirurgia rimane centrale, ma la scelta della tecnica e l’eventuale uso adiuvante del denosumab devono basarsi su una valutazione completa che integri:
- La clinica del paziente
- La classificazione radiologica di Campanacci
- L’imaging avanzato (la Risonanza Magnetica è fondamentale per definire l’estensione locale)
- La diagnostica molecolare (immunoistochimica H3.3 G34W e analisi mutazionale H3F3A)
Il futuro? Vedo un ruolo crescente per tecniche di imaging ancora più sofisticate, come la radiomica (l’analisi computerizzata di un gran numero di caratteristiche quantitative estratte dalle immagini mediche) e l’intelligenza artificiale (AI). Questi strumenti potrebbero aiutarci a caratterizzare meglio la biologia del tumore in modo non invasivo, a pianificare la chirurgia con maggiore precisione (magari con modelli 3D) e a predire il rischio di recidiva in modo più accurato, integrando dati radiologici, istologici e molecolari.

Certo, il nostro studio ha dei limiti: è retrospettivo, il numero di pazienti trattati con denosumab è piccolo e l’analisi radiologica avanzata è stata fatta solo su un sottogruppo. Serviranno studi prospettici multicentrici più ampi per validare questi risultati e definire protocolli ottimali per l’uso del denosumab (durata, timing rispetto alla chirurgia, strategie di sospensione).
In conclusione, affrontare un tumore a cellule giganti dell’osso oggi significa combinare l’esperienza chirurgica con le più moderne tecnologie diagnostiche e terapeutiche. La classificazione di Campanacci ci guida ancora, ma l’immunoistochimica H3.3 e l’analisi mutazionale ci danno conferme preziose. Il denosumab ci offre un’arma in più per i casi difficili, aiutandoci a preservare la funzione articolare. E l’orizzonte è ricco di promesse, con l’AI e la radiomica pronte a rendere la nostra lotta contro questo tumore ancora più precisa ed efficace. Un percorso affascinante, non trovate?
Fonte: Springer