Trichoderma: Svelato il Segreto della Sua Arma Segreta, il 6-PP!
Ciao a tutti, appassionati di scienza e meraviglie della natura! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico dei funghi, in particolare di un genere che è un vero supereroe per le nostre piante: il Trichoderma. Questi funghi sono famosi per essere degli ottimi agenti di biocontrollo, capaci di proteggere le colture da malattie e persino di stimolarne la crescita. Ma come fanno? Uno dei loro “superpoteri” risiede nella produzione di molecole speciali, i metaboliti secondari. Tra questi, uno dei più studiati e intriganti è il 6-pentil-alfa-pirone, o più semplicemente 6-PP.
Un Composto Misterioso e Potente
Il 6-PP non è una scoperta recente, pensate che è stato identificato più di 50 anni fa! È una piccola molecola volatile, responsabile del caratteristico odore di cocco emanato da alcune specie di Trichoderma, come il nostro protagonista di oggi, Trichoderma atroviride. Ma il 6-PP non è solo “profumo”. Ha dimostrato di avere notevoli proprietà:
- Antifungine: È in grado di inibire la crescita di funghi patogeni per le piante, come Botrytis cinerea (la muffa grigia) e Rhizoctonia solani.
- Promotore della crescita vegetale: Influenza l’architettura delle radici delle piante, ad esempio stimolando lo sviluppo delle radici laterali, il che può migliorare l’assorbimento di acqua e nutrienti.
- Molecola segnale: Sembra agire come un segnale chimico, sia per il fungo stesso (auto-segnalazione), influenzando la crescita delle ife e la fusione cellulare (importante per il micoparasitismo), sia nella comunicazione con le piante, potenziandone le difese.
Insomma, un composto davvero versatile e fondamentale per il ruolo ecologico e biotecnologico di Trichoderma. Eppure, nonostante decenni di studi, la sua “ricetta” biochimica, la via biosintetica che porta alla sua produzione, era rimasta un mistero.
La Pista Sbagliata e la Nuova Ipotesi
Inizialmente, si pensava che il 6-PP derivasse dalla degradazione di acidi grassi come l’acido linoleico, attraverso un enzima chiamato lipossigenasi. Sembrava logico, ma… sorpresa! Esperimenti successivi, in cui il gene della lipossigenasi (lox1) in T. atroviride è stato eliminato, hanno dimostrato che la produzione di 6-PP non veniva influenzata. Addirittura, la rimozione di un altro gene (tmk1), che normalmente reprimeva lox1, portava a un *aumento* della produzione di 6-PP! Chiaramente, la strada era un’altra.
Qui entra in gioco una classe di molecole molto diffusa nei funghi: i polichetidi. Molti composti con una struttura simile al 6-PP (contenente un anello α-pirone) sono prodotti proprio attraverso la via dei polichetidi. Questa via metabolica è orchestrata da enzimi complessi chiamati Polichetide Sintasi (PKS). Questi enzimi funzionano come delle vere e proprie “fabbriche molecolari” che assemblano piccole unità di base (derivate dall’acetil-CoA e dal malonil-CoA) per costruire catene polichetidiche, che poi vengono modificate e ripiegate per formare il prodotto finale. Spesso, i geni che codificano per le PKS e per gli altri enzimi necessari alla “ricetta” si trovano raggruppati uno vicino all’altro nel genoma del fungo, formando quelli che chiamiamo Cluster Genici Biosintetici (BGC). Era questa la pista giusta?

La Caccia al Gene PKS Giusto
Armati di questa nuova ipotesi, ci siamo messi alla ricerca nel genoma di T. atroviride P1 (un ceppo noto per essere un ottimo produttore di 6-PP). Utilizzando strumenti bioinformatici come antiSMASH, che scansionano i genomi alla ricerca di BGC, abbiamo identificato diversi cluster potenziali. Uno in particolare ha attirato la nostra attenzione, contenente un gene che codifica per una PKS di Tipo I, che abbiamo chiamato pks1 (ID proteina 453700).
Perché proprio pks1? Beh, diversi indizi puntavano in quella direzione:
- Espressione genica: Sapevamo da studi precedenti che T. atroviride produce più 6-PP al buio o in condizioni di luce ridotta. Analizzando l’espressione dei geni nel cluster sospetto, abbiamo visto che pks1 e alcuni geni vicini erano significativamente più “accesi” (sovraregolati) proprio in condizioni di luce ridotta rispetto a cicli luce-buio. Una coincidenza? Difficile!
- Analisi filogenetica: Confrontando la sequenza della proteina Pks1 con altre PKS note da diversi funghi, abbiamo scoperto che si raggruppava strettamente con PKS responsabili della sintesi di altri pironi (come alternariolo, solanapirone, citreoviridina). Era in buona compagnia!
- Struttura dell’enzima: Analizzando i domini funzionali della proteina Pks1, abbiamo trovato quelli tipici di una PKS di Tipo I “altamente riducente” (HR-PKS), come KS, AT, KR, DH, ER e persino un dominio metiltransferasi (MT), anche se quest’ultimo sembra non essere attivo per il 6-PP. Mancava però il dominio Tioesterasi (TE), spesso responsabile del rilascio del prodotto finale. Questo non era un problema: in molte HR-PKS che producono pironi, la ciclizzazione e il rilascio avvengono spontaneamente o sono catalizzati da altri domini, come il KS. La struttura era compatibile con la produzione di un pirone come il 6-PP.
- Genomica comparativa: Abbiamo cercato cluster simili a quello di pks1 in altri genomi di Trichoderma. Risultato? Cluster ortologhi (simili per struttura e funzione) sono stati trovati in specie note produttrici di 6-PP (come T. gamsii e T. asperellum), ma erano completamente assenti in specie non produttrici (come T. reesei e T. virens). Bingo!
Tutti gli indizi convergevano su pks1 come gene chiave per la sintesi del 6-PP. Ma in scienza, gli indizi non bastano: servono le prove!
L’Esperimento Definitivo: Knock-out!
Per avere la certezza matematica, dovevamo fare una cosa: eliminare il gene pks1 da T. atroviride e vedere cosa succedeva alla produzione di 6-PP. Grazie alla potente tecnica di editing genetico CRISPR/Cas9, abbiamo creato dei mutanti “knock-out”, chiamati ∆pks1, in cui il gene pks1 era stato rimosso e sostituito con un marcatore di resistenza a un antibiotico (igromicina B). Abbiamo ottenuto tre mutanti indipendenti (∆pks1A, ∆pks1B, ∆pks1C) per essere sicuri dei risultati.
A livello di crescita e aspetto, i mutanti ∆pks1 erano indistinguibili dal ceppo selvatico (WT, Wild Type) su piastra: stessa velocità di crescita, stessa produzione di spore (conidi). Questo suggerisce che pks1 e il suo prodotto non sono essenziali per la vita “normale” del fungo, ma piuttosto per le sue interazioni ecologiche.

E la produzione di 6-PP? Analizzando gli estratti delle colture con tecniche come la cromatografia su strato sottile ad alte prestazioni (HPTLC) e la cromatografia liquida ad alta risoluzione accoppiata alla spettrometria di massa (LC-HRMS), il risultato è stato netto: mentre il ceppo WT produceva abbondantemente 6-PP, nei tre mutanti ∆pks1… il 6-PP era completamente scomparso! Questa era la prova regina: Pks1 è essenziale per la biosintesi del 6-PP in Trichoderma atroviride.
Non solo: analisi più approfondite con LC-HRMS/MS hanno rivelato che il ceppo WT produceva anche piccole quantità di almeno nove composti strutturalmente correlati al 6-PP (derivati con gruppi cheto, idrossi, doppi legami aggiuntivi o con l’anello lattonico aperto). Anche questi derivati erano completamente assenti nei mutanti ∆pks1, confermando che l’intera “famiglia” di composti deriva dall’attività di Pks1, magari per piccole “imperfezioni” nel processo di riduzione durante la sintesi o per modifiche successive operate da altri enzimi.
Implicazioni Funzionali: Antagonismo e Interazione con le Piante
Ok, abbiamo capito chi fa il 6-PP. Ma cosa comporta la sua assenza per le capacità di Trichoderma?
Abbiamo testato l’attività antifungina dei metaboliti secreti dal WT e dal mutante ∆pks1A contro i patogeni Botrytis cinerea e Rhizoctonia solani. Come previsto, il mutante senza 6-PP mostrava un’attività inibitoria significativamente ridotta rispetto al WT contro entrambi i patogeni. Questo conferma che il 6-PP (e forse i suoi derivati) contribuisce in modo importante al “cocktail” di sostanze antifungine secrete da T. atroviride.
Anche negli esperimenti di confronto diretto (“dual culture”), dove Trichoderma e il patogeno crescono sulla stessa piastra, abbiamo visto delle differenze. Contro B. cinerea, il WT riusciva a inibire e sovrastare completamente il patogeno molto più efficacemente del mutante ∆pks1. Contro R. solani, entrambi (WT e mutante) mostravano una forte attività antagonista, suggerendo che contro questo specifico patogeno, altri meccanismi o molecole siano più determinanti, sebbene il 6-PP contribuisca comunque all’inibizione a distanza.
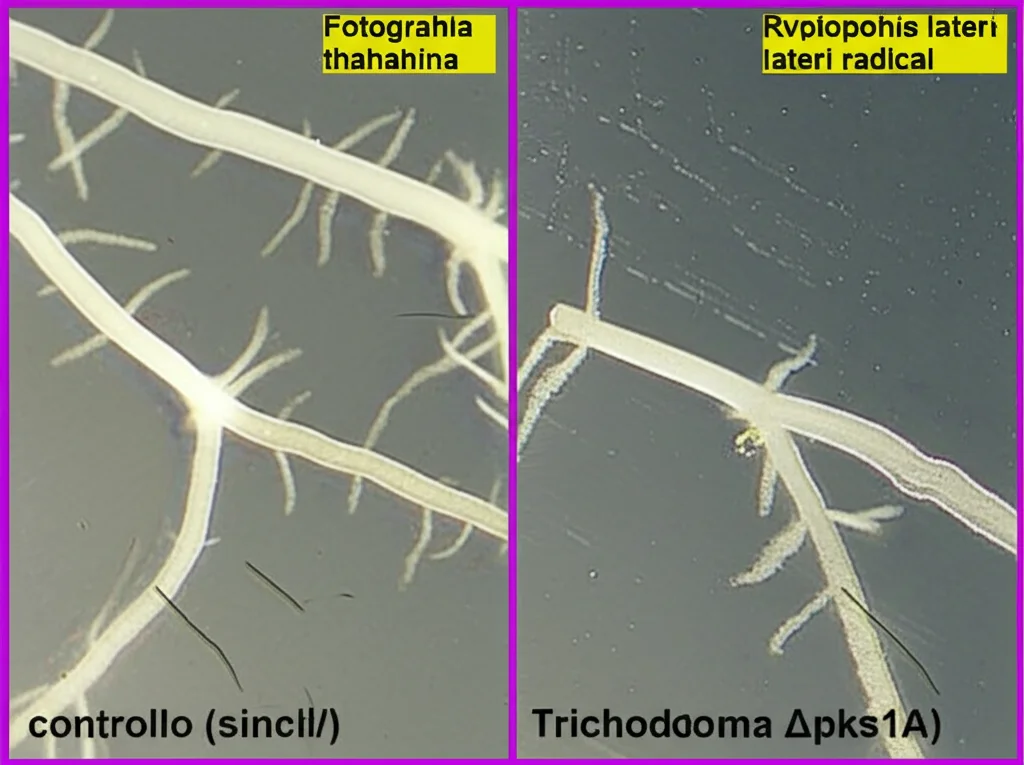
E l’interazione con le piante? Qui abbiamo avuto una sorpresa! Abbiamo fatto crescere piantine di Arabidopsis thaliana (una pianta modello) da sole, o in presenza del T. atroviride WT o del mutante ∆pks1A. Come atteso, il WT promuoveva la crescita delle piante (aumento della lunghezza della radice primaria, del numero di radici laterali e del peso fresco) rispetto al controllo. Ma, colpo di scena: le piante che interagivano con il mutante ∆pks1A mostravano un miglioramento *ancora maggiore*, specialmente nel numero di radici laterali! Questo risultato è intrigante e un po’ controintuitivo, dato che studi precedenti avevano indicato che il 6-PP *induceva* la formazione di radici laterali (anche se poteva inibire la radice primaria a certe concentrazioni). Cosa significa? Forse l’assenza di 6-PP rimuove un effetto inibitorio sulla crescita generale che maschera quello promotore sulle radici laterali? O forse l’eliminazione di pks1 causa altri cambiamenti nel metabolismo del fungo che portano a una maggiore produzione di *altre* sostanze che stimolano le radici? È un aspetto che merita sicuramente ulteriori indagini!
Uno Sguardo al Cluster: Non Solo Pks1
Ricordate il BGC, il pacchetto di geni attorno a pks1? Abbiamo visto che almeno cinque geni in quel cluster mostravano un pattern di espressione simile a pks1 (più attivi con poca luce), suggerendo che lavorino insieme. Tra questi, due sono particolarmente interessanti:
- Un gene che codifica per una proteina “zinc finger” di tipo C3H1 (ID 243072). Queste proteine sono spesso regolatori trascrizionali, capaci di legare DNA o RNA e influenzare l’espressione genica in risposta a segnali ambientali o ormonali. Potrebbe essere un attore chiave nel regolare la produzione di 6-PP in base alla luce o ad altri stimoli (magari segnali dalla pianta?).
- Un gene per una Lytic Polysaccharide Monooxygenase (LPMO) (ID 314935). Le LPMO sono enzimi che aiutano a degradare polisaccaridi resistenti come cellulosa e chitina. La sua co-regolazione con pks1 suggerisce un’azione coordinata: mentre il 6-PP indebolisce o uccide funghi competitori o patogeni, la LPMO potrebbe aiutare a degradarne le pareti cellulari (nel micoparasitismo) o a utilizzare substrati vegetali (nella vita saprofitica). Un’accoppiata strategica!
La caratterizzazione funzionale di questi altri geni del cluster sarà fondamentale per capire appieno come viene regolata la sintesi di 6-PP e come si integra nelle diverse strategie di vita di Trichoderma.

Conclusioni e Prospettive Future
Eccoci alla fine del nostro viaggio! Abbiamo finalmente svelato il mistero della biosintesi del 6-PP, identificando nella polichetide sintasi Pks1 l’enzima chiave e nel suo cluster genico la “fabbrica” responsabile. Questa scoperta non è solo una curiosità scientifica:
- Ci aiuta a capire meglio le basi molecolari del biocontrollo esercitato da Trichoderma.
- Apre la strada alla possibilità di ingegnerizzare ceppi di Trichoderma con una produzione ottimizzata di 6-PP (o magari di altri metaboliti), per creare agenti di biocontrollo ancora più efficaci.
- Potrebbe portare allo sviluppo del 6-PP come biopesticida diretto, contribuendo a un’agricoltura più sostenibile ed ecologica.
- Solleva nuove, affascinanti domande sull’interazione complessa tra i metaboliti fungini e le risposte delle piante.
Il mondo dei metaboliti secondari fungini è un tesoro di molecole bioattive ancora in gran parte da esplorare. Aver decifrato la “ricetta” del 6-PP è un passo importante, che ci avvicina a sfruttare appieno il potenziale di funghi benefici come Trichoderma per un futuro più verde. La ricerca continua!
Fonte: Springer







