Toxoplasma: Come Fregare il Parassita Togliendogli il suo ‘Taglia e Cuci’ Genetico!
Ciao a tutti! Oggi voglio raccontarvi una storia affascinante che arriva direttamente dal mondo microscopico, una storia che parla di parassiti furbissimi, di meccanismi cellulari intricati e di come, a volte, togliere un singolo pezzo dal puzzle possa mandare tutto all’aria, aprendo però strade inaspettate. Parliamo di Toxoplasma gondii, un nome che forse non vi dirà molto, ma è un parassita incredibilmente diffuso (infetta tantissimi animali a sangue caldo, umani inclusi!) e con un ciclo vitale davvero complesso.
Un Parassita Intelligente e Pieno di Segreti
Pensate, questo piccolo organismo unicellulare appartiene al phylum Apicomplexa, un gruppo di “cattivi ragazzi” che include anche i responsabili della malaria (Plasmodium) e della criptosporidiosi (Cryptosporidium). Toxoplasma è un maestro del trasformismo: esiste in diverse forme (tachizoiti, bradizoiti, sporozoiti) e sa come passare da una fase acuta dell’infezione, dove si moltiplica velocemente come tachizoite, a una fase cronica, dove si “addormenta” formando cisti piene di bradizoiti, rimanendo nascosto nel nostro corpo per tutta la vita.
Ma come fa a gestire questi cambiamenti? Serve un controllo precisissimo dell’espressione dei suoi geni. E qui entra in gioco una caratteristica sorprendente di Toxoplasma: il suo genoma è strapieno di introni. Gli introni sono sequenze di DNA che si trovano all’interno dei geni ma che non codificano per proteine; devono essere rimossi dal “messaggio” genetico (l’RNA messaggero o mRNA) prima che questo possa essere tradotto in una proteina funzionante. Questo processo di “taglia e cuci” si chiama splicing.
Ora, mentre nel lievito solo il 5% dei geni ha introni, in Toxoplasma ben il 75% ne è provvisto! Perché un parassita, che tende a semplificare il suo genoma evolvendosi, si tiene tutta questa complessità? È una domanda che ci ha incuriosito moltissimo. L’ipotesi è che avere tanti introni e un meccanismo di splicing efficiente permetta a Toxoplasma una regolazione più fine e versatile dei suoi geni, fondamentale per adattarsi ai diversi ospiti e alle diverse fasi del suo ciclo vitale.
Cdc5: Il Regista dello Splicing?
Lo splicing è un processo complesso, orchestrato da una macchina molecolare chiamata spliceosoma, composta da piccole molecole di RNA (snRNA) e tantissime proteine. Tra queste proteine, una in particolare ha attirato la nostra attenzione: Cdc5. Questa proteina è super conservata in animali, piante e funghi, ed è nota per essere essenziale per l’attivazione dello spliceosoma. Ma cosa fa esattamente in Toxoplasma? Era un mistero.
Per scoprirlo, siamo andati a caccia di TgCdc5 (la versione di Cdc5 in Toxoplasma). L’abbiamo trovata: è una proteina di 888 amminoacidi con domini specifici per legare acidi nucleici. Abbiamo visto che è espressa sia nei tachizoiti (la forma attiva) che nei bradizoiti (la forma dormiente), ma con una localizzazione diversa: nel nucleo dei tachizoiti e, sorprendentemente, nel citoplasma dei bradizoiti.
Poi, ci siamo chiesti: con chi lavora TgCdc5? Usando tecniche di immunoprecipitazione e spettrometria di massa, abbiamo “pescato” le proteine che interagiscono con TgCdc5 nei tachizoiti. E bingo! Abbiamo trovato un sacco di proteine dello spliceosoma, confermando che TgCdc5 è proprio lì, nel cuore della macchina dello splicing. Tra i suoi partner principali c’era TgPrp19, un altro pezzo grosso dello spliceosoma. Abbiamo confermato la loro interazione e visto che si trovano insieme nel nucleo del parassita. Non solo, abbiamo scoperto che TgCdc5 lega specificamente alcuni degli RNA dello spliceosoma (U2 e U6). E, ciliegina sulla torta, abbiamo dimostrato che TgCdc5 e TgPrp19 di Toxoplasma sono così simili alle loro controparti nel lievito da poterle sostituire funzionalmente! Questo ci dice che, nonostante le differenze evolutive, il ruolo centrale di queste proteine nello splicing è rimasto lo stesso.

Cosa Succede Senza Cdc5? Il Caos!
A questo punto, la domanda era ovvia: cosa succede se togliamo di mezzo TgCdc5? Per farlo, abbiamo usato una tecnica ingegnosa basata su CRISPR/Cas9 e un sistema chiamato “mAID” (mini auxin-inducible degron). In pratica, abbiamo modificato geneticamente i parassiti in modo che la loro proteina TgCdc5 avesse attaccata una piccola “etichetta” (mAID-HA). Aggiungendo una molecola specifica (l’auxina, IAA) al terreno di coltura, potevamo indurre la degradazione rapidissima e specifica di TgCdc5-mAID-HA.
I risultati sono stati… drammatici! Abbiamo prima testato l’effetto su un “gene reporter”, un costrutto artificiale che produce una proteina luminosa (luciferasi) solo se un introne specifico viene correttamente rimosso tramite splicing. Quando abbiamo eliminato TgCdc5, la produzione di luciferasi è crollata, e abbiamo visto che l’RNA messaggero corrispondente rimaneva “non processato”, con l’introne ancora dentro. Lo splicing era andato in tilt!
Ma gli effetti non si fermavano lì. I parassiti senza TgCdc5 smettevano completamente di replicarsi. Osservandoli al microscopio, vedevamo forme strane, parassiti staccati all’interno del vacuolo che li ospita, divisioni cellulari anomale. Non riuscivano più a formare le tipiche “placche” di lisi sulle cellule ospiti, segno che il loro ciclo vitale era bloccato. E bastava togliere TgCdc5 per poche ore (già 2 ore erano sufficienti) per impedire loro di riprendersi. Anche la capacità di invadere nuove cellule ospiti e di uscire da quelle infette era gravemente compromessa. Insomma, senza il suo “regista” dello splicing, Toxoplasma era K.O.
Scavando nel Caos: Il Transcriptoma Impazzito
Per capire meglio cosa stesse succedendo a livello molecolare, abbiamo analizzato l’intero set di RNA messaggeri (il transcriptoma) dei parassiti con e senza TgCdc5. I risultati dell’RNA-seq sono stati impressionanti: l’assenza di TgCdc5 causava cambiamenti drastici nell’abbondanza di oltre 1100 geni! Circa 730 geni erano “spenti” o ridotti (downregolati), mentre 394 erano “accesi” o aumentati (upregolati).
Analizzando quali processi biologici erano influenzati (analisi di Gene Ontology – GO), abbiamo visto che i geni downregolati erano coinvolti in funzioni vitali come:
- Organizzazione dei cromosomi e degli organelli
- Ciclo cellulare
- Replicazione e riparazione del DNA
- Risposta allo stress
- Mantenimento dell’omeostasi cellulare
I geni upregolati, invece, sembravano legati a tentativi di regolazione della trascrizione e del metabolismo dell’RNA. In pratica, togliere TgCdc5 mandava in tilt i processi di crescita e replicazione, mentre il parassita cercava disperatamente di mantenere un equilibrio.
Molti geni essenziali per l’invasione (come RON2, RON4, RON5, AMA1), per la replicazione del DNA (MCM4, polimerasi, ligasi) e per il citoscheletro (Tubuline, Miosine) erano significativamente ridotti, spiegando i difetti che avevamo osservato. Anche geni importanti per il ripiegamento corretto delle proteine e per la loro degradazione erano downregolati.
E lo splicing? Analizzando più a fondo i dati di RNA-seq, abbiamo confermato che il difetto principale era la ritenzione degli introni (Intron Retention – IR). Nell’82% degli eventi di splicing alterati, gli introni semplicemente non venivano rimossi. Altri tipi di errori, come l’uso di siti di splicing alternativi o il salto di esoni, erano molto meno comuni. Questo suggerisce che TgCdc5 è fondamentale per lo splicing “canonico”, quello che deve avvenire correttamente per la maggior parte dei geni.

Conseguenze Cellulari a Cascata
I problemi non finivano qui. Abbiamo visto che i parassiti senza TgCdc5 si bloccavano nel ciclo cellulare, sia nella fase G1 (prima della replicazione del DNA) sia nella fase S (durante la replicazione). Non riuscivano a progredire. Inoltre, mostravano segni evidenti di danno al DNA (usando un test chiamato TUNEL) e un aumento della morte cellulare programmata (apoptosi).
Curiosamente, nonostante il caos a livello di RNA, la sintesi proteica globale non sembrava diminuire nelle prime ore dopo la deplezione di TgCdc5. Questo ci ha fatto pensare: forse il parassita continuava a tradurre mRNA “sbagliati”, pieni di introni? O forse i problemi erano a valle? Usando un colorante specifico (Proteostat), abbiamo scoperto che nei parassiti senza TgCdc5 si accumulavano aggregati di proteine mal ripiegate. Questo poteva essere dovuto sia alla downregolazione dei geni per il controllo qualità delle proteine, sia alla possibile traduzione di mRNA aberranti. Questi aggregati proteici sono tossici e possono contribuire all’arresto del ciclo cellulare.
Il Colpo di Scena: Bradizoiti Abortivi
E qui arriva una delle scoperte più sorprendenti. Lo stress cellulare indotto dalla perdita di TgCdc5 spingeva i parassiti (che erano della linea RH, normalmente non capace di formare cisti spontaneamente) a tentare una trasformazione! Abbiamo visto nei dati di RNA-seq e poi anche a livello proteico (con analisi di proteomica) che venivano attivati i geni e le proteine tipiche della fase bradizoite, quella dormiente e incistata. I regolatori chiave che normalmente reprimono la trasformazione in bradizoite erano “spenti”, mentre quelli che la attivano erano “accesi”.
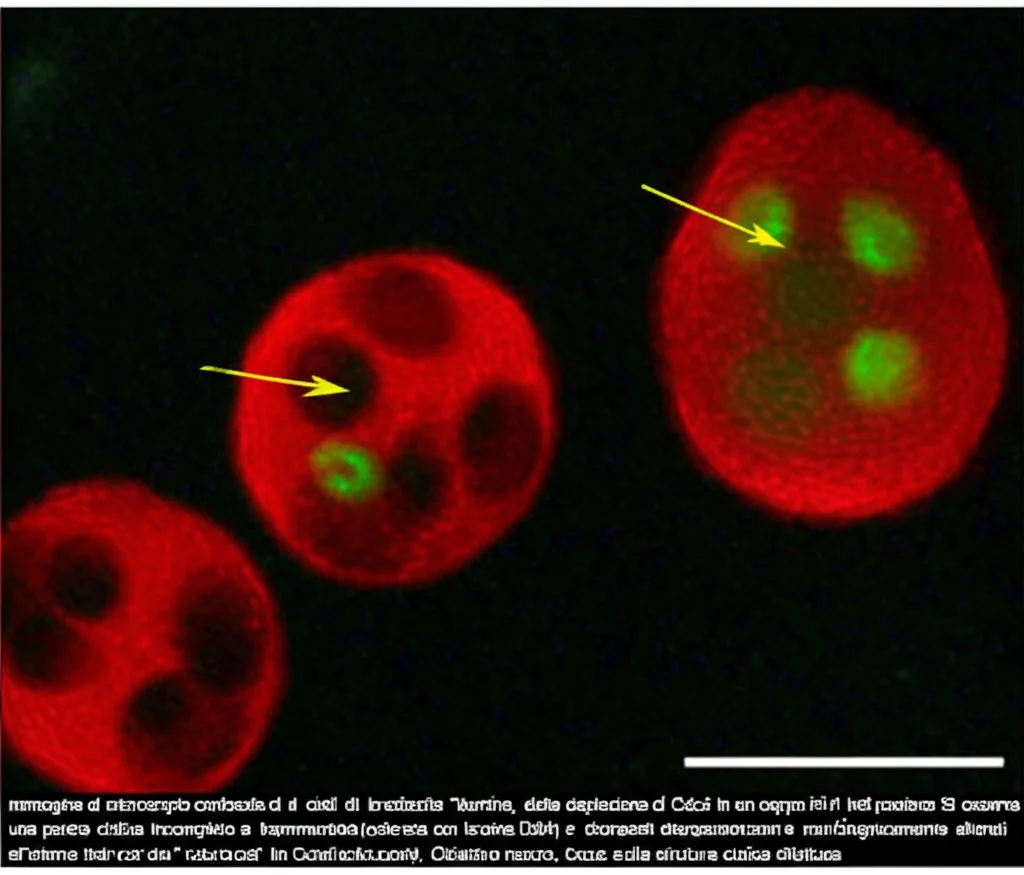
Abbiamo confermato questa conversione spontanea osservando i parassiti al microscopio nel tempo: dopo qualche giorno di trattamento con IAA (per eliminare TgCdc5), i parassiti iniziavano a esprimere marcatori specifici dei bradizoiti (come BAG1) e a formare strutture simili a cisti (positive alla lectina DBA). Tuttavia, questo tentativo di “mettersi al sicuro” era destinato a fallire. Le cisti che si formavano erano difettose, si disintegravano dopo pochi giorni, e i bradizoiti al loro interno non erano vitali. Non riuscivano a tornare alla forma tachizoite attiva una volta rimosso lo stimolo (IAA). Era una formazione di bradizoiti abortiva: il parassita sentiva il pericolo e provava a incistarsi, ma senza uno splicing funzionante, non aveva le proteine giuste per completare il processo e sopravvivere in quella forma.
La Prova del Nove: L’Importanza in Vivo e l’Immunità
Tutto questo era molto interessante in provetta, ma TgCdc5 è essenziale anche durante un’infezione reale in un ospite? Per scoprirlo, abbiamo fatto esperimenti sui topi. Abbiamo infettato topi con i nostri parassiti TgCdc5-mAID-HA. A un gruppo di topi abbiamo dato l’IAA (per eliminare TgCdc5 nei parassiti), all’altro gruppo un placebo (veicolo).
I risultati sono stati netti. Tutti i topi del gruppo di controllo (senza IAA) sono morti a causa della toxoplasmosi acuta entro 11 giorni. Invece, tutti i topi trattati con IAA sono sopravvissuti! L’eliminazione di TgCdc5 bloccava completamente la replicazione del parassita e preveniva l’infezione letale. Anche interrompendo il trattamento con IAA dopo 15 giorni, i topi rimanevano sani, e non trovavamo traccia di parassiti (né DNA né cisti) nel loro cervello o cuore a 30 giorni. Questo dimostra in modo inequivocabile che TgCdc5 è assolutamente indispensabile per la sopravvivenza e la patogenesi di Toxoplasma nell’ospite.
Ma c’è di più. I parassiti senza TgCdc5, pur non riuscendo a causare la malattia, erano comunque presenti per un po’ nell’organismo prima di essere eliminati. Questo breve incontro era sufficiente a stimolare una risposta immunitaria? Abbiamo fatto un altro esperimento: abbiamo “immunizzato” dei topi usando i parassiti TgCdc5-mAID-HA e trattandoli con IAA per bloccarne la crescita. Poi, dopo qualche settimana, li abbiamo “sfidati” con una dose letale di parassiti normali (senza deplezione di Cdc5).
Incredibilmente, i topi precedentemente esposti ai parassiti “attenuati” dalla mancanza di Cdc5 erano completamente protetti dall’infezione letale! Avevano sviluppato una forte immunità. Abbiamo anche testato se questa immunità potesse proteggere durante la gravidanza, un momento critico per la trasmissione di Toxoplasma dalla madre al feto. Abbiamo osservato una protezione parziale: le femmine immunizzate avevano meno problemi di gravidanza rispetto ai controlli quando infettate.

Conclusioni e Prospettive Future
Questa ricerca ci ha mostrato quanto sia cruciale il fattore di splicing Cdc5 per Toxoplasma gondii. È essenziale per mantenere l’integrità del suo complesso transcriptoma, ricco di introni. La sua rimozione causa un effetto domino devastante: blocca lo splicing, altera l’espressione di centinaia di geni, impedisce la replicazione, danneggia il DNA, provoca accumulo di proteine anomale e induce un tentativo fallito di trasformazione in bradizoite.
Ma la cosa forse più eccitante è che questa “debolezza” del parassita potrebbe essere sfruttata a nostro vantaggio. L’incapacità di sopravvivere senza Cdc5, unita alla forte risposta immunitaria protettiva generata dai parassiti attenuati, apre prospettive interessanti per lo sviluppo di nuove strategie terapeutiche o vaccinali contro la toxoplasmosi. Immaginate un vaccino vivo attenuato basato su ceppi modificati in cui Cdc5 può essere controllato: potrebbe offrire una protezione robusta senza il rischio di causare malattia cronica (dato che i bradizoiti formati non sono vitali e il ceppo RH non forma cisti persistenti).
È un esempio lampante di come studiare a fondo la biologia di base di un parassita possa svelare i suoi talloni d’Achille e fornirci nuove armi per combatterlo. La strada è ancora lunga, ma aver capito l’importanza cruciale di questo “regista” dello splicing in Toxoplasma è sicuramente un passo avanti significativo!
Fonte: Springer







