TIPE2: La Proteina Che Spegne l’Incendio nei Polmoni Durante la Sepsi Bloccando la Morte Cellulare Programmata
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante e, purtroppo, molto serio: la sepsi e il danno che può fare ai nostri polmoni. Immaginate una risposta infiammatoria potentissima del nostro corpo a un’infezione, talmente forte da diventare essa stessa un pericolo. Questo è ciò che accade nella sepsi, una condizione che può portare a disfunzioni multiple degli organi (MODS) e, in particolare, a un grave danno polmonare acuto (ALI) o addirittura alla sindrome da distress respiratorio acuto (ARDS). Vi dico subito che queste sono complicazioni comuni e spesso fatali nelle unità di terapia intensiva.
Nonostante i progressi della medicina, capire a fondo perché la sepsi colpisca così duramente i polmoni è ancora una sfida, e questo limita l’efficacia delle cure. Ecco perché la ricerca si sta concentrando sui meccanismi più intimi, a livello cellulare.
La Morte Cellulare: Non Solo Apoptosi e Necrosi
Per anni abbiamo pensato alla morte cellulare principalmente in termini di apoptosi (una sorta di suicidio cellulare programmato e pulito) e necrosi (una morte più caotica e dannosa). Ma la realtà, come spesso accade nella biologia, è molto più complessa. Recentemente è emerso un nuovo concetto: la PANoptosi. Non è un errore di battitura! Si tratta di una forma di morte cellulare programmata che è un vero e proprio “cocktail” di apoptosi, piroptosi (una morte infiammatoria) e necroptosi (un’altra forma di morte programmata ma diversa dall’apoptosi).
La PANoptosi sembra essere un meccanismo cruciale con cui le cellule cercano di eliminare i patogeni e limitare i danni durante infiammazioni severe, come quelle della sepsi. Il problema è che, se questo processo sfugge di mano, può peggiorare la situazione, contribuendo al deterioramento di malattie infiammatorie, cardiovascolari, neurodegenerative e persino del cancro. Nella sepsi, questa morte cellulare “integrata” e l’infiammazione che ne deriva possono portare a danni cronici ai tessuti e agli organi.
Entra in Scena TIPE2: Un Regolatore Immunitario Chiave
Qui entra in gioco la protagonista della nostra storia: una proteina chiamata TIPE2 (TNF-α-induced protein 8-like 2). Pensate a TIPE2 come a un vigile urbano del sistema immunitario. È una proteina immunoregolatrice fondamentale, nota per mettere un freno all’attività eccessiva di cellule immunitarie come i linfociti T, i linfociti B e, soprattutto per il nostro racconto, i macrofagi. Mantenere l’equilibrio del sistema immunitario è il suo mestiere, e si è già dimostrata protettiva in diverse condizioni patologiche, come le malattie infiammatorie intestinali e quelle del fegato.
La domanda che ci siamo posti (noi, come comunità scientifica, intendo!) è stata: che ruolo gioca TIPE2 nel contesto drammatico del danno polmonare indotto dalla sepsi? Potrebbe essere lei la chiave per controllare quella pericolosa PANoptosi nei macrofagi alveolari, le cellule immunitarie residenti nei nostri polmoni?

L’Esperimento: Topi, Cellule e un Modello di Sepsi
Per capirlo, abbiamo condotto uno studio (descritto nell’articolo originale su Springer) utilizzando modelli animali e cellulari. Abbiamo usato topi normali (wild-type, WT) e topi geneticamente modificati ai quali era stata “spenta” la proteina TIPE2 (TIPE2 KO – knockout). Per simulare la sepsi umana, abbiamo utilizzato un modello chiamato CLP (Cecal Ligation and Puncture), che consiste nel legare e perforare una parte dell’intestino del topo per indurre un’infezione e una risposta infiammatoria sistemica simile alla sepsi.
Abbiamo osservato cosa succedeva ai polmoni di questi topi 24 ore dopo l’intervento CLP. Inoltre, abbiamo lavorato in vitro con una linea cellulare di macrofagi alveolari di topo (chiamati MH-S). In alcune di queste cellule, abbiamo “potenziato” l’espressione di TIPE2 (sovraespressione, TIPE2 OE) per vedere l’effetto opposto rispetto al knockout. Poi, abbiamo stimolato queste cellule con LPS (lipopolisaccaride, un componente della parete dei batteri Gram-negativi che mima l’infezione batterica) per indurre una risposta infiammatoria.
Risultati Shock: Cosa Succede Senza TIPE2?
I risultati sono stati chiari e piuttosto preoccupanti per i topi senza TIPE2.
- Danno Polmonare Aggravato: I polmoni dei topi TIPE2 KO sottoposti a CLP mostravano danni molto più gravi rispetto ai topi normali. Gli alveoli erano più spessi, pieni di cellule infiammatorie – un quadro decisamente peggiore. I punteggi di danno polmonare erano significativamente più alti.
- Sopravvivenza Ridotta: Purtroppo, i topi TIPE2 KO avevano anche tassi di sopravvivenza a 7 giorni significativamente inferiori dopo la CLP rispetto ai topi WT. La mancanza di TIPE2 li rendeva più vulnerabili.
- Infiammazione alle Stelle: Analizzando il fluido di lavaggio broncoalveolare (BALF) e il siero, abbiamo visto che i topi TIPE2 KO avevano più edema polmonare (indicato dal rapporto peso umido/secco del polmone e dalla concentrazione di proteine nel BALF) e livelli molto più alti di citochine infiammatorie come TNF-α, IL-1β, IL-1 e IL-18. L’infiammazione era fuori controllo.
- PANoptosi Scatenata: Qui arriva il punto cruciale. Nei polmoni dei topi TIPE2 KO, abbiamo trovato livelli molto più alti delle proteine chiave coinvolte nelle diverse vie di morte cellulare che compongono la PANoptosi:
- Necroptosi: Aumento di RIPK1 e, soprattutto, della forma attivata (fosforilata) di MLKL (P-MLKL).
- Apoptosi: Riduzione della proteina anti-apoptotica BCL2 e aumento della proteina pro-apoptotica BAX, oltre a un aumento della Caspasi-3 attivata (C-Caspase 3).
- Piroptosi: Aumento dei livelli di Gasdermina D attivata (GSDMD-N) e della Caspasi-1 attivata (C-Caspase 1).
Inoltre, abbiamo notato un aumento significativo di una proteina chiamata ZBP1, che sta emergendo come un importante iniziatore della PANoptosi.
In pratica, senza TIPE2, la PANoptosi nei polmoni durante la sepsi andava su di giri, contribuendo pesantemente all’infiammazione e al danno tissutale.
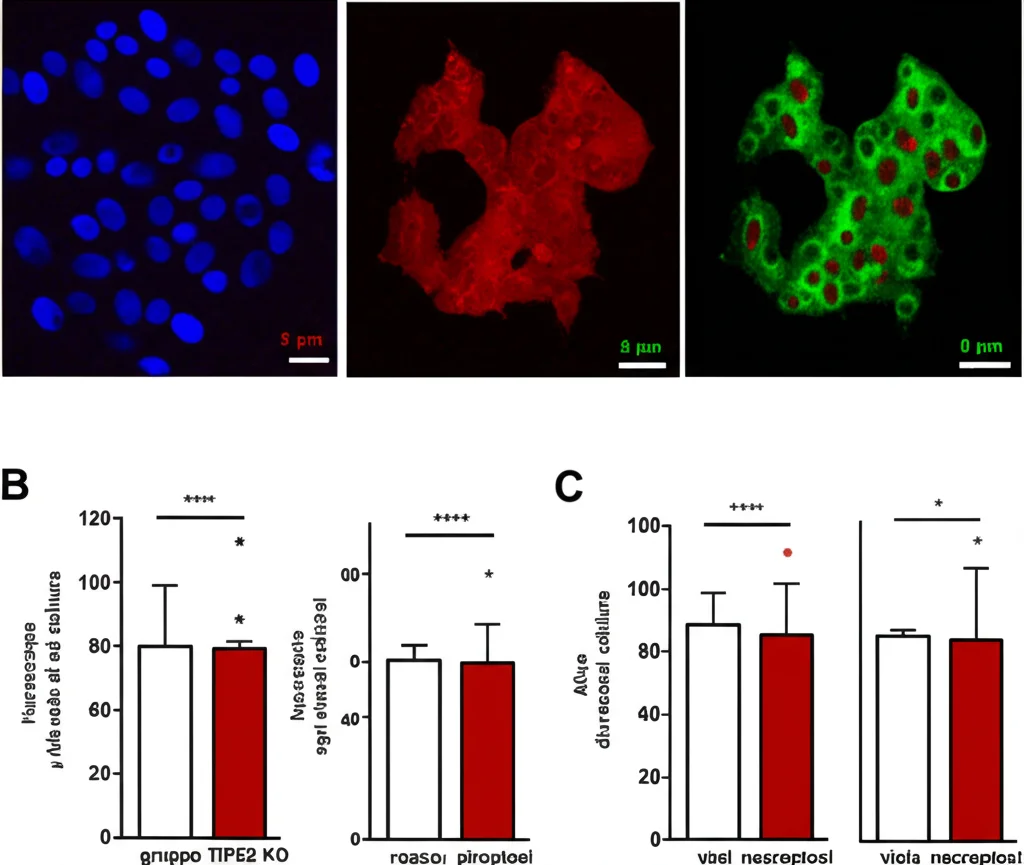
La Svolta: Cosa Succede Potenziando TIPE2?
Ora, la parte più speranzosa. Cosa è successo quando abbiamo fatto il contrario, cioè quando abbiamo aumentato i livelli di TIPE2 nei macrofagi alveolari MH-S in coltura e li abbiamo stimolati con LPS? I risultati sono stati l’immagine speculare di quelli precedenti:
- Meno Infiammazione: Le cellule con più TIPE2 producevano significativamente meno citochine infiammatorie (IL-1β, IL-18, TNF-α) dopo la stimolazione con LPS. TIPE2 agiva come un freno.
- Meno Morte Cellulare: L’analisi con citometria a flusso (usando Annexin V e PI) ha mostrato una netta riduzione della morte cellulare nelle cellule TIPE2 OE rispetto ai controlli. TIPE2 proteggeva le cellule.
- Meno Attivazione dell’Inflammasoma: L’immunofluorescenza ha rivelato una ridotta attivazione dell’inflammasoma NLRP3 (un complesso proteico chiave per la piroptosi) nelle cellule TIPE2 OE.
- PANoptosi Inibita: Coerentemente, l’analisi Western blot ha confermato che la sovraespressione di TIPE2 riduceva significativamente i livelli delle proteine chiave della PANoptosi indotta da LPS:
- Necroptosi: Meno RIPK1 e P-MLKL.
- Apoptosi: Più BCL2, meno BAX e meno C-Caspase 3.
- Piroptosi: Meno GSDMD-N e meno Caspasi-1 attivata.
Quindi, potenziare TIPE2 nei macrofagi sembrava spegnere efficacemente l’interruttore della PANoptosi e ridurre l’infiammazione.
Il Meccanismo: Come Fa TIPE2 a Fermare la PANoptosi?
Ma come fa TIPE2 a fare tutto questo? Sembra che il suo bersaglio principale sia proprio quella proteina ZBP1 che avevamo visto aumentata nei topi KO. ZBP1 può dare il via alla PANoptosi attivando una cascata di segnali che coinvolge un’altra proteina adattatrice chiamata TRIF. Questa via ZBP1-TRIF può poi innescare contemporaneamente apoptosi, necroptosi e piroptosi.
Nei nostri esperimenti sui macrofagi, abbiamo visto che la sovraespressione di TIPE2 non solo riduceva i livelli di ZBP1 indotti da LPS, ma anche quelli di TRIF e l’attivazione della Caspasi-8 (un’altra proteina chiave all’incrocio di queste vie di morte). Inoltre, l’immunofluorescenza ha mostrato che TIPE2 impediva la formazione di complessi fisici tra le proteine delle diverse vie di morte (ASC della piroptosi, Caspasi-8 dell’apoptosi e RIPK3 della necroptosi) che si formano durante la PANoptosi ZBP1-dipendente.
In parole povere, TIPE2 sembra agire come un guardiano che impedisce a ZBP1 di dare l’allarme generale (via TRIF) che scatena la PANoptosi nei macrofagi alveolari durante un’infiammazione come quella indotta da LPS.

Perché Tutto Questo è Importante?
Capire questi meccanismi è fondamentale perché il danno polmonare da sepsi è ancora una delle principali cause di morte nei pazienti critici. Questo studio ci dice che TIPE2 è un fattore cruciale nel mantenere l’equilibrio tra sopravvivenza e morte cellulare nei polmoni durante la tempesta infiammatoria della sepsi. La sua assenza scatena la PANoptosi, peggiorando il danno. Al contrario, la sua presenza (o il suo potenziamento) la inibisce, proteggendo il tessuto polmonare.
Certo, come in ogni ricerca, ci sono ancora aspetti da approfondire. Ad esempio, bisognerebbe studiare più nel dettaglio l’interazione fisica diretta tra TIPE2 e ZBP1. Ma i risultati sono promettenti.
L’idea che emerge è che TIPE2 potrebbe essere un nuovo bersaglio terapeutico. Immaginate farmaci in grado di aumentare l’attività di TIPE2 o mimarne l’effetto: potrebbero rappresentare una strategia innovativa per trattare il danno polmonare acuto indotto dalla sepsi e, potenzialmente, altre malattie infiammatorie in cui la PANoptosi gioca un ruolo negativo.
È un campo di ricerca in rapida evoluzione, ma studi come questo ci danno una speranza concreta per affrontare meglio una condizione così devastante come la sepsi. La piccola proteina TIPE2 potrebbe davvero fare la differenza nel calmare l’incendio nei polmoni.
Fonte: Springer