Tie2 nei Miofibroblasti: Una Nuova Speranza Contro la Faccia Nascosta del Carcinoma Orale?
Amici della scienza e curiosi di scoperte mediche, oggi vi porto nel cuore pulsante della ricerca oncologica, dove stiamo svelando meccanismi incredibilmente complessi che potrebbero rivoluzionare il modo in cui combattiamo alcuni tumori. Parliamo di carcinoma orale, una brutta bestia, e di come certi “collaboratori” insospettabili nel suo microambiente possano peggiorare le cose… o diventare il nostro prossimo bersaglio terapeutico!
Il Campo di Battaglia: Il Microambiente Tumorale e i Suoi Attori Nascosti
Immaginate il tumore non come una massa isolata di cellule impazzite, ma come un vero e proprio ecosistema, il cosiddetto microambiente tumorale (TME). Qui, le cellule cancerose non sono sole; convivono e interagiscono con una miriade di altre cellule “normali” che, purtroppo, spesso vengono reclutate e corrotte dal tumore stesso per aiutarlo a crescere, diffondersi e resistere alle terapie. Tra questi attori, un ruolo da protagonisti lo giocano i fibroblasti associati al cancro (CAF). Pensate a loro come a degli operai specializzati che, invece di costruire strutture sane, finiscono per edificare una fortezza per il nemico.
I Miofibroblasti Associati al Cancro (CAF): Amici o Nemici?
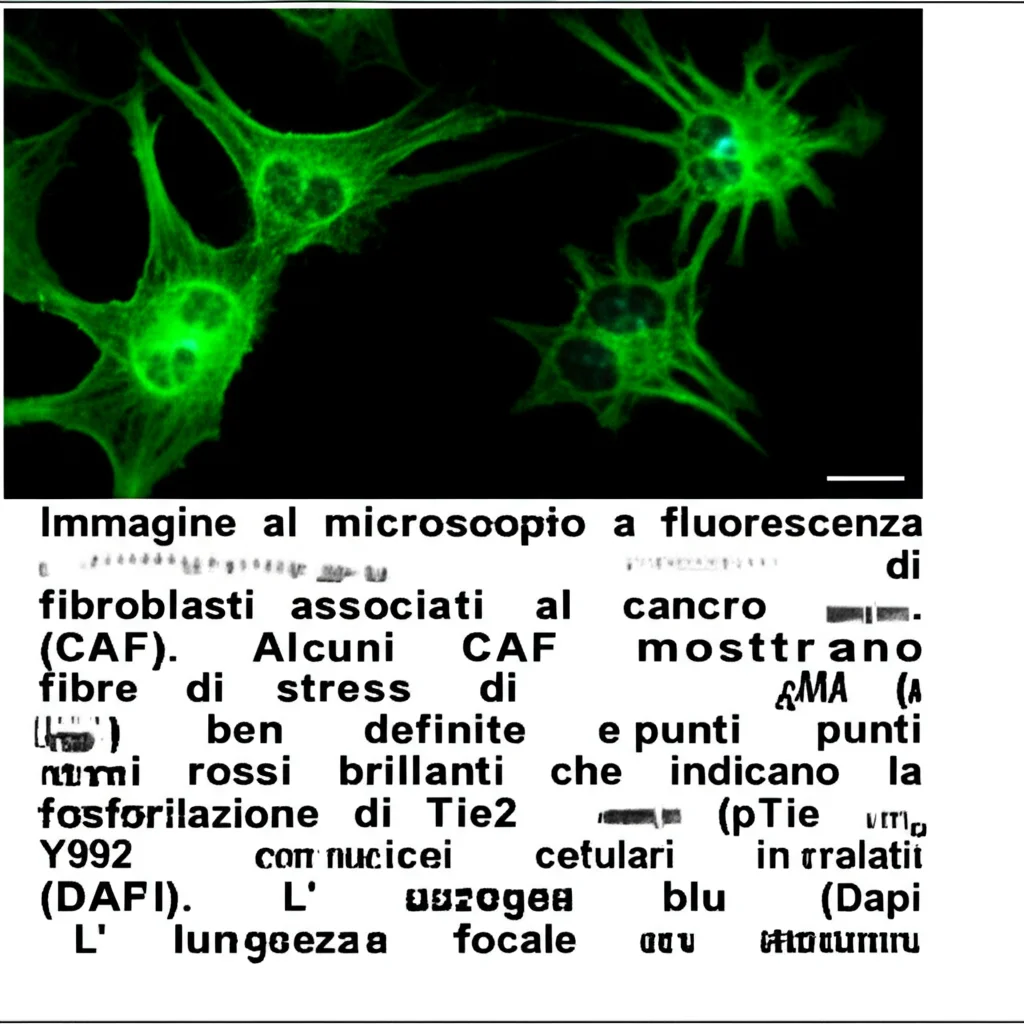
Ora, non tutti i CAF sono uguali. Alcuni, in particolare quelli che acquisiscono caratteristiche “miofibroblastiche” (li chiameremo miofibroblasti-CAF o C2-CAF), sono particolarmente subdoli. Questi super-CAF sono caratterizzati da un’elevata espressione di una proteina chiamata α-actina muscolare liscia (αSMA) e dalla formazione di fibre di stress, un po’ come se fossero dei muscoli in miniatura pronti a rimodellare l’ambiente a favore del tumore. Studi precedenti, inclusi i nostri, avevano già suonato un campanello d’allarme: la presenza massiccia di questi C2-CAF nello stroma tumorale (il tessuto connettivo di supporto) è un indicatore indipendente di prognosi infausta nei pazienti con carcinoma orale. Sembra che questi C2-CAF siano capaci di “istruire” le cellule tumorali, spingendole verso uno stato di maggiore “staminalità”.
Ma cos’è la staminalità in un tumore? È la capacità di alcune cellule cancerose di auto-rigenerarsi a lungo termine, dando origine a diverse sotto-popolazioni di cellule tumorali. Queste cellule staminali tumorali (SLCCs) sono considerate il motore dell’iniziazione del cancro, della sua progressione e, ahimè, della sua resistenza ai trattamenti. Colpire queste SLCCs è cruciale se vogliamo davvero sconfiggere il cancro. Ma come fanno i C2-CAF a promuovere questa pericolosa staminalità? Il meccanismo preciso era ancora avvolto nel mistero. Fino ad ora.
Tie2: Una Chiave Inaspettata nel Destino dei CAF
Ed ecco che entra in gioco il protagonista della nostra storia: una chinasi recettoriale chiamata Tie2 (Tunica Interna Endothelial Cell Kinase 2, o TEK). Finora, Tie2 era conosciuta principalmente per il suo ruolo nelle cellule endoteliali, quelle che rivestono i vasi sanguigni, dove regola la maturazione dei vasi e la loro integrità. Ma la scienza è piena di sorprese, e abbiamo scoperto che Tie2 gioca un ruolo cruciale anche nei nostri miofibroblasti-CAF.
Nel nostro ultimo studio, abbiamo esplorato a fondo cosa succede quando i CAF “normali” (che chiamiamo C1-CAF) vengono esposti al TGFβ (Transforming Growth Factor beta), una molecola segnale abbondante nel microambiente tumorale. Ebbene, il TGFβ induce i C1-CAF a trasformarsi nei più aggressivi C2-CAF, i miofibroblasti. E indovinate un po’? Questa trasformazione è strettamente legata all’attivazione di Tie2!
Abbiamo osservato che l’induzione con TGFβ porta a una serie di eventi a catena:
- Viene reclutato un enzima chiamato istone deacetilasi 2 (HDAC2) sul promotore di un gene chiamato ANGPT2.
- ANGPT2, che normalmente agisce come un antagonista di Tie2 (cioè lo spegne), viene così “silenziato” o ridotto.
- Con l’antagonista fuori gioco, Tie2 si fosforila (in una specifica posizione, Y992) e si attiva.
- Tie2 attivato, a sua volta, accende un’altra proteina chiamata SRC (anch’essa fosforilata in Y418).
- Questo circuito SRC/ROCK porta alla formazione delle famigerate fibre di stress positive per αSMA e al fenotipo miofibroblastico.
In pratica, il TGFβ “sblocca” Tie2 sopprimendo il suo freno naturale (ANGPT2), e questo scatena la trasformazione dei CAF.
Come Tie2 Trasforma i CAF e ‘Corrompe’ le Cellule Tumorali
Ma la storia non finisce qui. La vera “bomba” è che questa segnalazione di Tie2 specifica dei CAF è responsabile di un effetto ancora più nefasto: la riprogrammazione delle cellule tumorali co-coltivate con essi. Le cellule cancerose, sotto l’influenza di questi CAF attivati da Tie2, iniziano a comportarsi come cellule embrionali, acquisendo uno stato “embryonic-like”. Questo significa maggiore capacità di iniziare tumori, maggiore motilità e, in generale, un comportamento più aggressivo.
Utilizzando tecniche avanzate come il sequenziamento dell’RNA a singola cellula (scRNAseq) e analisi bioinformatiche approfondite, abbiamo visto che l’attività di Tie2 nei CAF induce una riprogrammazione dinamica dell’espressione genica nelle cellule maligne. In particolare, abbiamo notato un aumento dei geni legati alla “migrazione cellulare” e una diminuzione di quelli legati alla “biosintesi proteica”. Immaginate cellule che smettono di “costruire” normalmente e si concentrano sul “muoversi” e invadere: un incubo per qualsiasi paziente.
Abbiamo poi verificato se questi meccanismi fossero presenti anche nei tumori umani. Analizzando campioni di carcinoma orale, abbiamo trovato una correlazione significativa tra alti livelli di αSMA (marcatore dei miofibroblasti-CAF) e alti livelli di Tie2 nello stroma tumorale. Non solo: analizzando dati pubblici di pazienti con carcinoma a cellule squamose della testa e del collo (HNSCC) dal The Cancer Genome Atlas (TCGA), abbiamo visto che i “punteggi” genetici derivati dai nostri moduli di espressione genica (quelli legati alla migrazione e alla biosintesi proteica) erano significativamente associati a una prognosi sfavorevole. Questo suggerisce fortemente che ciò che abbiamo osservato in laboratorio ha una rilevanza clinica diretta.
Dalla Provetta ai Pazienti: Le Prove Schiaccianti
Per essere sicuri delle nostre scoperte, non ci siamo fermati alle analisi molecolari. Abbiamo testato l’effetto di bloccare Tie2. E i risultati sono stati entusiasmanti!
- In vitro: Utilizzando sia il silenziamento genico di Tie2 sia un piccolo inibitore molecolare specifico per Tie2 nei CAF, abbiamo visto che la trasformazione in miofibroblasti indotta da TGFβ veniva bloccata. Ancora più importante, anche i CAF già trasformati in miofibroblasti potevano regredire a uno stato meno aggressivo se trattati con l’inibitore di Tie2!
- Quando le cellule tumorali venivano esposte a CAF con Tie2 “spento”, la loro capacità di formare sferoidi 3D (un test per la staminalità) e l’espressione di marcatori di staminalità diminuivano drasticamente.
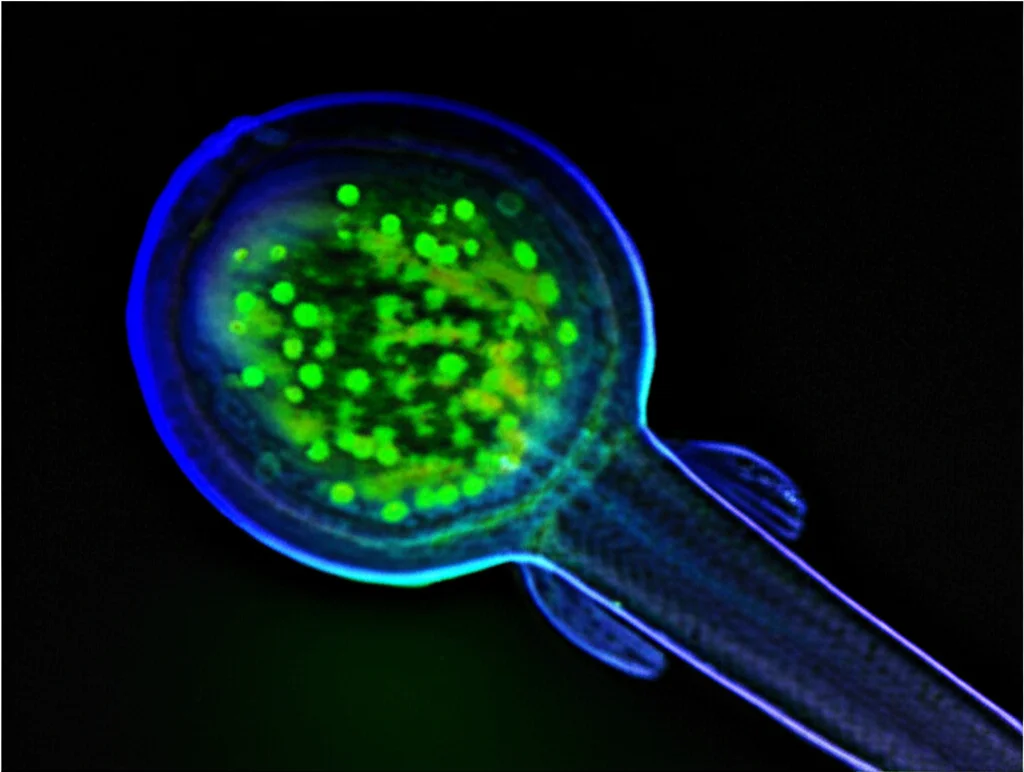
- In vivo: Abbiamo usato modelli animali, come embrioni di zebrafish e trapianti allogenici in topi singenici. Le cellule tumorali “educate” da CAF con Tie2 attivo mostravano una maggiore capacità di formare tumori e una maggiore mortalità negli zebrafish. Al contrario, se Tie2 nei CAF veniva inibito, la capacità tumorigenica delle cellule cancerose si riduceva significativamente.
Questi esperimenti ci dicono chiaramente che l’attività di Tie2 nei CAF è un motore potente per la plasticità delle cellule tumorali e la loro aggressività.
Un Nuovo Bersaglio Terapeutico all’Orizzonte?
Cosa significa tutto questo per i pazienti? Significa che abbiamo identificato un nuovo potenziale bersaglio terapeutico: l’attività di Tie2 nei CAF. Invece di colpire solo le cellule tumorali, potremmo mirare a questi “collaboratori corrotti” nel microambiente. Se riusciamo a “spegnere” Tie2 nei CAF, potremmo bloccare la riprogrammazione delle cellule tumorali verso uno stato più aggressivo e staminale, rendendo il tumore meno pericoloso e, si spera, più sensibile ad altre terapie.
È interessante notare che il TGFβ è da tempo nel mirino della ricerca come bersaglio, ma la sua doppia natura (a volte protettiva, a volte pro-tumorale) ha reso difficili gli approcci terapeutici diretti. Colpire Tie2 nei CAF potrebbe essere un modo più specifico e forse più sicuro per contrastare gli effetti negativi del TGFβ nel microambiente tumorale del carcinoma orale. Esistono già inibitori di Tie2, come il Rebastinib, in fase di sperimentazione clinica per altre forme di cancro, il che apre scenari promettenti.
Certo, la strada è ancora lunga. Dobbiamo capire meglio quali fattori specifici secreti dai CAF attivati da Tie2 siano responsabili della riprogrammazione delle cellule tumorali e come questo si integri con altri componenti del microambiente. Ma ogni grande viaggio inizia con un primo passo, e questo studio ha certamente aperto una nuova, affascinante via nella lotta contro il carcinoma orale. La speranza è che, comprendendo meglio questi dialoghi cellulari, possiamo finalmente trovare il modo di zittire le voci che spingono il cancro verso il suo lato più oscuro.
Fonte: Springer







