TFG: La Proteina ‘Guardiano’ che Mette Ordine tra Reticolo Endoplasmatico e Golgi
Un’Autostrada Cellulare Trafficata: L’Interfaccia ER-Golgi
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore delle nostre cellule, in un luogo incredibilmente trafficato e fondamentale per la nostra vita: l’interfaccia tra il Reticolo Endoplasmatico (ER) e l’Apparato del Golgi. Immaginate l’ER come una gigantesca fabbrica che produce proteine e lipidi, e il Golgi come l’ufficio postale che li smista e li invia alla loro destinazione finale. Tra questi due organelli c’è una zona di scambio cruciale, una sorta di hub logistico di dimensioni minuscole, meno di 500 nanometri!
Qui il traffico è bidirezionale e intensissimo. Da un lato, abbiamo le vescicole COPII che trasportano il “carico” appena prodotto dall’ER verso il Golgi (direzione anterograda). Dall’altro, le vescicole COPI fanno il percorso inverso, riportando indietro materiale da riciclare (direzione retrograda). Ora, la domanda che ci siamo posti per decenni è: come fa la cellula a gestire questo viavai pazzesco in uno spazio così ristretto senza che i “camion” (le vescicole) si scontrino, mescolino il loro contenuto e mandino all’aria l’organizzazione? Studi passati avevano mostrato che, in qualche modo, le macchine COPII e COPI erano tenute separate spazialmente – COPII al centro dell’interfaccia, COPI alla periferia – ma il “come” rimaneva un mistero.
Il Sospettato Principale: La Proteina TFG
Negli ultimi anni, l’attenzione si è concentrata su alcune proteine che sembrano “auto-organizzarsi” in questa zona, formando delle strutture collettive. Tra queste, una in particolare ha attirato la nostra curiosità: la proteina TFG (Trk-fused gene). Studi precedenti avevano suggerito che TFG fosse importante per la morfologia dell’interfaccia ER-Golgi e per l’esportazione di carico dall’ER, specialmente quello più ingombrante come il collagene. Si ipotizzava che potesse formare un “condensato biomolecolare”, una specie di gel o gocciolina proteica, che agisse da “colla molecolare” per tenere uniti ER e Golgi. Ma poteva questo ipotetico condensato spiegare anche la separazione del traffico? Era ora di andare a vedere più da vicino.
La Sorprendente Scoperta: TFG Forma Condensati Cavi e Porosi
Armati di tecniche avanzate, abbiamo iniziato a indagare. Prima di tutto, abbiamo localizzato TFG con precisione millimetrica (anzi, nanometrica!) nelle cellule. E voilà: TFG si trovava esattamente nello spazio tra i siti di uscita dall’ER (ERES) e la faccia cis del Golgi, proprio dove serviva! La proteina Sec16, un’altra sospettata, sembrava invece più confinata vicino all’ER.
Il passo successivo è stato provare a ricreare la magia *in vitro*. Abbiamo purificato la proteina TFG da cellule umane (un processo non banale per ottenere una proteina pura e funzionale!). E qui è arrivata la sorpresa: in condizioni fisiologiche, TFG ha iniziato spontaneamente ad aggregarsi, ma non in ammassi disordinati. Formava delle strutture affascinanti: dei condensati anisotropi (cioè non uniformi al loro interno) che, a dimensioni più piccole (<500 nm), apparivano come delle sfere cave! Incredibilmente, le dimensioni di queste sfere cave corrispondevano quasi perfettamente a quelle dell’interfaccia ER-Golgi che avevamo misurato nelle cellule (circa 300-350 nm di diametro). Immaginate delle minuscole spugne o gabbie sferiche fatte di proteina TFG.
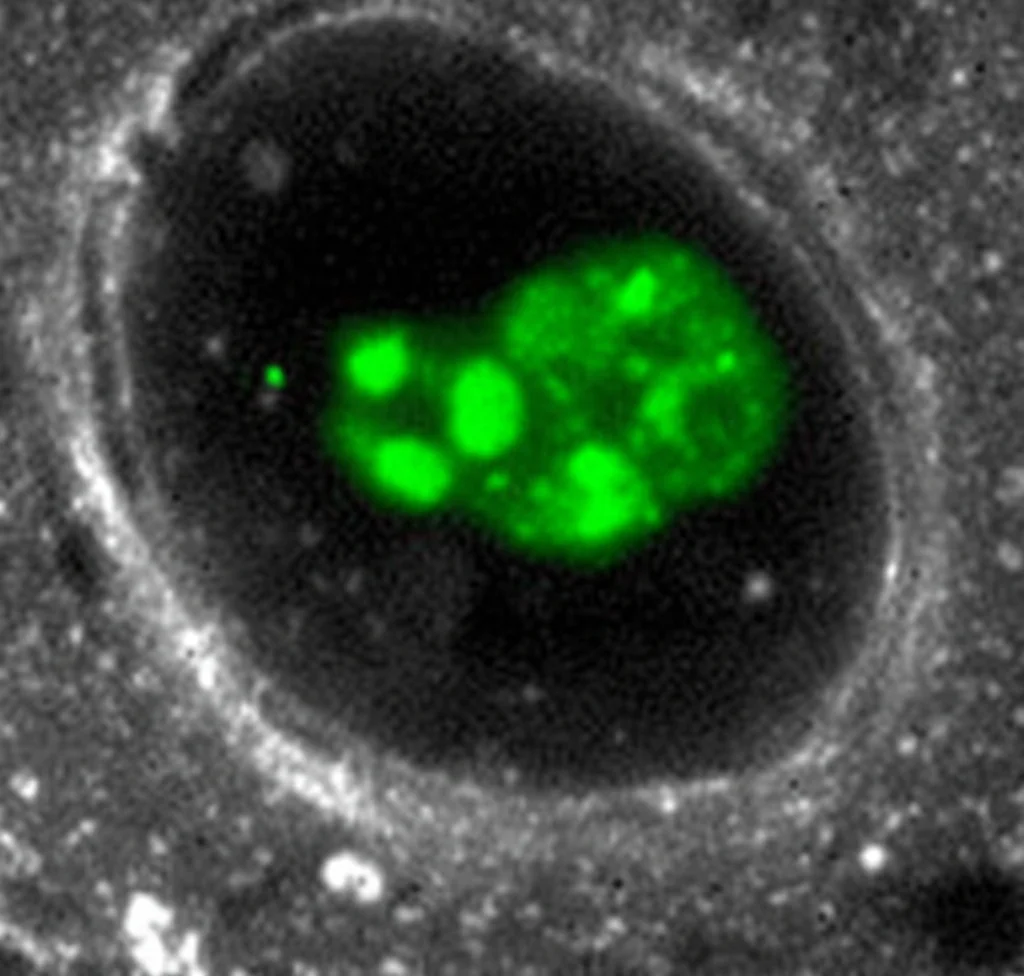
Abbiamo confermato questa scoperta anche nelle cellule vive, marcando TFG endogeno (cioè quello prodotto naturalmente dalla cellula) con una proteina fluorescente tramite CRISPR/Cas9. Anche lì, TFG formava foci discreti con una distribuzione non uniforme, e le dimensioni erano le stesse osservate *in vitro*. Sembrava proprio che TFG avesse la capacità intrinseca di auto-organizzarsi in queste gabbie cave della giusta misura per strutturare l’interfaccia ER-Golgi.
Come Fa TFG a Organizzarsi Così? Il Modello “Stickers and Spacers”
Ma qual è il segreto di questa auto-organizzazione? TFG è in gran parte una proteina “intrinsecamente disordinata” (IDR), cioè non ha una struttura tridimensionale fissa come molte altre proteine. All’interno di queste regioni disordinate, però, abbiamo notato la presenza di residui amminoacidici idrofobici (che “non amano” l’acqua) distribuiti a intervalli regolari. Questi residui ci hanno ricordato il modello “stickers and spacers” (adesivi e spaziatori), proposto recentemente per spiegare come le proteine IDR possano formare condensati.
L’idea è che questi “stickers” idrofobici interagiscano tra loro, un po’ come pezzetti di velcro, guidando l’aggregazione della proteina. La cosa interessante è che diverse parti della regione disordinata di TFG potevano formare condensati cavi indipendentemente, suggerendo che questi “stickers” fossero distribuiti lungo quasi tutta la porzione disordinata. E la prova del nove: se eliminavamo geneticamente questi residui “sticker”, TFG perdeva completamente la capacità di formare condensati nelle cellule!
Inoltre, abbiamo scoperto che questa condensazione è sensibile alla temperatura. A temperature leggermente inferiori a quella fisiologica (sotto i 30°C), i condensati si dissolvevano, mentre a temperature leggermente superiori (40°C) tendevano a fondersi e a diventare più “spugnosi”. A 30°C apparivano quasi perfettamente sferici. Questo comportamento è tipico delle interazioni guidate da “stickers”, la cui forza dipende dalla temperatura, e suggerisce che TFG sia “ottimizzato” per formare queste strutture proprio alla temperatura del nostro corpo (37°C).
Il Guardiano Selettivo: Un Setaccio Molecolare all’Interfaccia
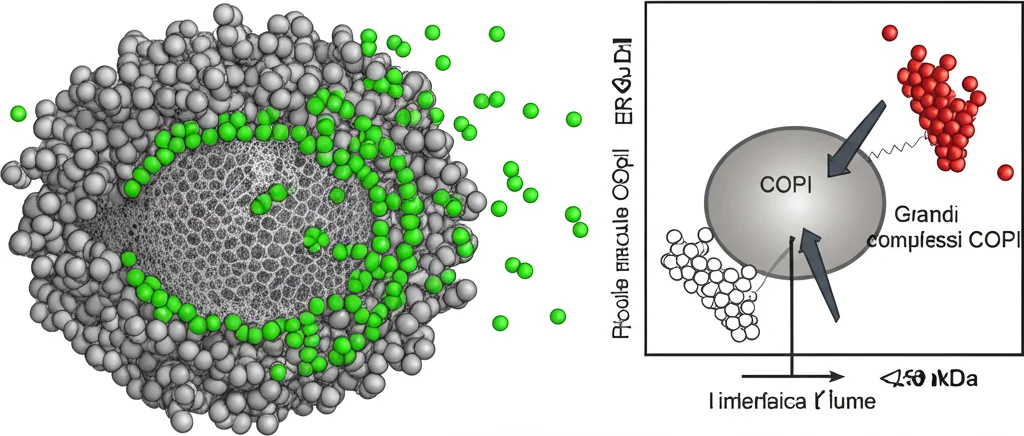
Ok, TFG forma queste gabbie cave. Ma a cosa servono? Guardando i condensati *in vitro* con microscopi potentissimi (elettronici a scansione e trasmissione), abbiamo notato un altro dettaglio cruciale: la superficie di queste gabbie non era continua, ma presentava dei piccoli pori irregolari, di diametro inferiore ai 10 nanometri!
Questa scoperta ci ha fatto accendere una lampadina: e se questi pori funzionassero come un setaccio molecolare? Abbiamo testato questa ipotesi incubando i condensati di TFG con molecole fluorescenti (destrani) di dimensioni diverse. Il risultato è stato netto: le molecole più piccole (fino a circa 250 kDa, che corrisponde a un diametro di circa 8 nm) riuscivano a entrare nel lume cavo del condensato, mentre quelle più grandi venivano escluse. Se eliminavamo gli “stickers” idrofobici, TFG formava ancora condensati (anche se più dinamici e sferici), ma questi perdevano la loro selettività e non escludevano più le molecole grandi. Quindi, la struttura porosa e la funzione di setaccio dipendono proprio da quegli specifici residui idrofobici!
 Springer
Springer