Linfoma Cerebrale: La Nuova Terapia R-MO Accende la Speranza! Risultati Incredibili dallo Studio di Fase II
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi sta davvero a cuore nel campo della ricerca medica, una di quelle notizie che ti fanno pensare: “Forse ci siamo!”. Parliamo di una forma di cancro particolarmente ostica: il linfoma primitivo del sistema nervoso centrale (PCNSL). Immaginate un nemico aggressivo che si nasconde proprio nel nostro centro di comando, il cervello o gli occhi, protetto da una barriera quasi invalicabile, la famosa barriera emato-encefalica (BBB). Questa barriera, che normalmente ci protegge, diventa un ostacolo enorme quando dobbiamo far arrivare i farmaci proprio lì dove servono.
La Sfida del PCNSL e i Limiti Attuali
Il PCNSL è un tipo di linfoma non-Hodgkin che, negli ultimi vent’anni, è diventato purtroppo più comune. La sua somiglianza con il linfoma diffuso a grandi cellule B (DLBCL) sistemico è solo superficiale, perché la localizzazione nel sistema nervoso centrale (SNC) cambia completamente le regole del gioco. Trovare la strategia terapeutica perfetta è un vero rompicapo.
Il cardine della terapia attuale è il metotrexato ad alte dosi (HDMTX). Su questa base si sono costruiti vari cocktail di farmaci, spesso aggiungendo il rituximab (un anticorpo monoclonale) e altri chemioterapici (come citarabina, vincristina, procarbazina, temozolomide, tiotepa – pensate a sigle come R-MA, R-MVP, R-MT, MATRix). Questi regimi hanno mostrato tassi di risposta globale (ORR) che vanno dal 35% al 74%, ma diciamocelo, sul lungo termine i risultati non sono ancora quelli che speriamo. E poi c’è il rovescio della medaglia: la tossicità, soprattutto a livello del sangue (ematologica), che può essere pesante, specialmente in periodi complicati come quello della pandemia di COVID-19. C’era un bisogno disperato di trovare qualcosa di più efficace e meno tossico.
Una Nuova Luce: Orelabrutinib e la Via del BTK
Qui entra in scena la biologia molecolare. Nel PCNSL, c’è un’attivazione “anomala” di un percorso chiamato NF-κB, che è un po’ come un interruttore che dice alle cellule tumorali di crescere e sopravvivere. Questo interruttore è spesso acceso a causa di segnali provenienti da altre vie, come quella del recettore delle cellule B (BCR) e del recettore Toll-like (TLR). E indovinate un po’? Esiste una proteina chiave che collega queste vie all’NF-κB: la tirosin-chinasi di Bruton (BTK).
Ecco l’idea geniale: se blocchiamo la BTK, forse possiamo spegnere quell’interruttore? Gli inibitori di BTK (BTKi) sono diventati un bersaglio logico. L’ibrutinib, un BTKi di prima generazione, ha mostrato qualche risultato nei pazienti con PCNSL recidivato/refrattario, ma i suoi effetti collaterali “fuori bersaglio” ne hanno limitato l’uso.
Ed è qui che arriva il nostro nuovo protagonista: Orelabrutinib. È un BTKi di seconda generazione, più selettivo (colpisce meglio il bersaglio giusto) e con meno effetti collaterali indesiderati. Ma la cosa più eccitante è che sembra attraversare molto meglio la barriera emato-encefalica! Studi preliminari hanno mostrato concentrazioni nel liquido cerebrospinale (CSF) molto più alte rispetto all’ibrutinib. In più, sembra funzionare particolarmente bene in coppia con il rituximab.
Da qui nasce l’idea di combinare Rituximab, Metotrexato ad alte dosi e Orelabrutinib in un nuovo regime, che abbiamo chiamato R-MO. E l’obiettivo? Testarlo come terapia di prima linea nei pazienti con nuova diagnosi di PCNSL.
Lo Studio di Fase II R-MO: Disegno e Pazienti
Abbiamo quindi avviato uno studio prospettico di Fase II, multicentrico e in aperto (cioè tutti sapevano cosa si stava somministrando). Lo studio è stato registrato (ChiCTR2100049483) e approvato eticamente. Abbiamo arruolato 37 pazienti con diagnosi confermata di PCNSL (del tipo a grandi cellule B), di età pari o superiore a 18 anni, con uno stato di performance generale (ECOG PS) da 0 a 2 (o anche 3-4 se dovuto a deficit neurologici) e una buona funzionalità degli organi.
Il percorso terapeutico prevedeva diverse fasi:
- Screening iniziale
- Terapia di induzione (18 settimane): Cicli di R-MO ogni 3 settimane (Rituximab il giorno 1, HDMTX 3.5 g/m² il giorno 2 con successivo ‘salvataggio’ con leucovorin, e Orelabrutinib 150 mg al giorno per via orale una volta normalizzati i livelli di metotrexato). Massimo 6 cicli.
- Consolidamento/Mantenimento: Per i pazienti che rispondevano (risposta parziale [PR] o completa [CR]), c’era l’opzione del trapianto autologo di cellule staminali (ASCT) se idonei (età ≤70 anni, buona funzione d’organo, etc.), seguito da mantenimento con Orelabrutinib orale (150 mg/giorno). Chi non era idoneo o rifiutava l’ASCT passava direttamente al mantenimento con Orelabrutinib. Il mantenimento dura fino a progressione, tossicità intollerabile, ritiro del consenso o per due anni.
- Follow-up continuo.
L’obiettivo primario era ambizioso: valutare il tasso di sopravvivenza libera da progressione (PFS) a 1 anno. Volevamo vedere se R-MO potesse superare il 75%, un bel salto rispetto al 50% circa dei controlli storici.
Risultati da Urlo: R-MO Supera le Aspettative!
E ora, tenetevi forte, perché i risultati sono davvero entusiasmanti! Su 37 pazienti:
- Risposta a metà induzione: Già qui, 36 pazienti su 37 (il 97.3%!) hanno mostrato una risposta, con 28 (75.7%) in remissione completa (CR) e 8 (21.6%) in remissione parziale (PR).
- Risposta post-induzione: Tra i 31 valutabili, il tasso di risposta globale (ORR) è stato del 90.3%, con un tasso di remissione completa (CRR) dell’87.1%.
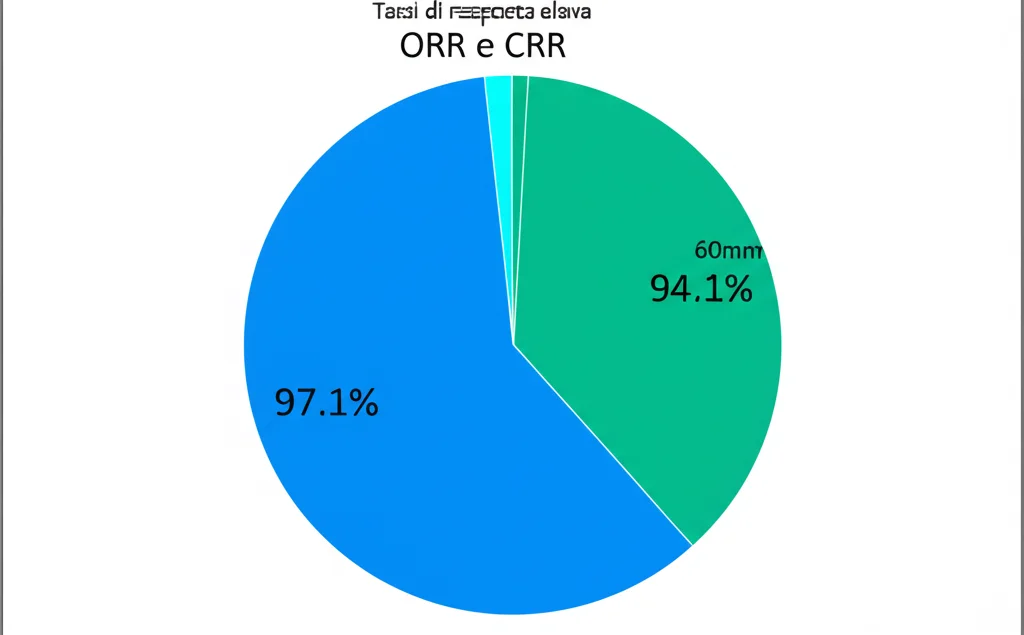
- Miglior risposta osservata: Durante tutto il trial, la migliore ORR ha raggiunto il 97.1% e la migliore CRR il 94.1%! Numeri davvero impressionanti.
Questi tassi di risposta elevati si sono visti in tutti i sottogruppi di pazienti, indipendentemente da fattori molecolari o clinici (come il tipo GCB/non-GCB o lo stato di ‘double-expressor’).
Ma la vera ciliegina sulla torta è stata la sopravvivenza libera da progressione (PFS). Con un follow-up mediano di 12.6 mesi:
- La PFS mediana non è stata raggiunta (il che è un ottimo segno!).
- Il tasso di PFS a 1 anno è stato dell’83.6%. Questo ha centrato e superato l’obiettivo primario dello studio!
- Anche la sopravvivenza globale (OS) a 1 anno è stata molto buona: 89.6%.
Questi dati sono nettamente superiori a quelli riportati in passato per regimi come MATRix (PFS a 1 anno 57-79%) o altri basati su HDMTX. L’aggiunta di Orelabrutinib sembra davvero fare la differenza, potenziando la fase di induzione.
E la Sicurezza? Un Profilo Gestibile
Ovviamente, quando si usano terapie potenti, bisogna tenere d’occhio gli effetti collaterali. Il regime R-MO ha mostrato un profilo di sicurezza che definiamo favorevole e gestibile. Gli eventi avversi (AE) più comuni sono stati:
- Neutropenia (bassi globuli bianchi neutrofili): 45.9%
- Linfocitopenia (bassi linfociti): 45.9%
- Infezioni: 45.9%
Gli AE di grado 3-4 (quelli più seri) più frequenti sono stati neutropenia (43.2%), infezioni (29.7%) e neutropenia febbrile (29.7%). Purtroppo, ci sono stati due decessi (5.4%) dovuti a infezioni polmonari gravi, avvenuti durante la fase di remissione, potenzialmente legati agli effetti immunosoppressivi combinati di Orelabrutinib e Rituximab. È un aspetto importante da monitorare attentamente.
Ci sono stati alcuni ritardi nel trattamento e riduzioni di dose del metotrexato in pochi pazienti a causa di problemi come danno renale o alterazioni della funzione epatica, ma è fondamentale notare che nessun paziente ha dovuto interrompere permanentemente la terapia a causa degli effetti collaterali. Questo suggerisce che, pur richiedendo attenzione, la tossicità è generalmente gestibile. Confrontato con regimi storici come MATRix, che riportavano tassi di infezioni gravi più alti, il nostro protocollo sembra mantenere l’efficacia riducendo parte della tossicità.
La Questione del Trapianto (ASCT) e il Mantenimento
Un dato interessante emerso è quello relativo al consolidamento con trapianto autologo di cellule staminali (ASCT). Dei 22 pazienti idonei, 8 hanno scelto l’ASCT seguito da mantenimento con Orelabrutinib, mentre altri 14 (inclusi 8 che hanno rifiutato l’ASCT) sono passati direttamente al mantenimento con Orelabrutinib. Ebbene, dopo un follow-up mediano di circa 8.6 mesi dalla fine dell’induzione, non c’è stata una differenza statisticamente significativa nella durata della remissione tra il gruppo trapiantato e quello non trapiantato (P=0.226).
Questo non significa che l’ASCT sia inutile, ma solleva domande importanti. Forse il mantenimento con un BTKi come Orelabrutinib è così efficace da rendere meno cruciale il consolidamento intensivo con ASCT? O forse abbiamo bisogno di più tempo e più pazienti per vedere una differenza? È un’area che richiederà ulteriori studi, magari trial randomizzati che confrontino direttamente ASCT vs mantenimento con BTKi. Per ora, il nostro protocollo prevedeva comunque il mantenimento con Orelabrutinib per 2 anni per tutti i responder, basandosi sull’alto rischio di recidiva nei primi due anni post-trattamento. L’efficacia a lungo termine di questa strategia di mantenimento è ancora da valutare appieno.
Guardando al Futuro: Cosa Ci Aspetta?
Questo studio di Fase II sul regime R-MO è davvero promettente. Abbiamo raggiunto l’endpoint primario con un tasso di PFS a 1 anno dell’83.6% e tassi di risposta altissimi. L’aggiunta di Orelabrutinib a HDMTX e Rituximab sembra offrire un vantaggio significativo per i pazienti con nuova diagnosi di PCNSL, con una sicurezza accettabile.
Certo, dobbiamo essere cauti. Si tratta di uno studio di Fase II con un numero limitato di pazienti (37), tutti cinesi, e il follow-up mediano è ancora relativamente breve (12.6 mesi). Servono conferme! Il prossimo passo logico è uno studio di Fase III randomizzato e controllato, su una popolazione più ampia e diversificata, che confronti R-MO (o un regime simile con BTKi) con gli standard attuali basati su HDMTX. Questo ci darà risposte definitive sull’efficacia e sulla sicurezza a lungo termine.
In conclusione, sento che siamo di fronte a un potenziale cambio di passo nel trattamento del PCNSL. La combinazione R-MO ha acceso una nuova speranza. Non vediamo l’ora di vedere i risultati a lungo termine e le conferme dagli studi futuri. Incrociamo le dita!
Fonte: Springer







