mRNA e Nanoparticelle: La Nuova Speranza Contro l’Arteriopatia Periferica!
Ciao a tutti! Oggi voglio parlarvi di una sfida medica enorme e di una frontiera della ricerca che mi appassiona tantissimo: l’arteriopatia periferica (PAD) e come la terapia a mRNA potrebbe rivoluzionare il modo in cui la combattiamo.
La Sfida dell’Arteriopatia Periferica (PAD)
Immaginate le vostre arterie come autostrade per il sangue. Nella PAD, queste “autostrade”, specialmente quelle delle gambe, si restringono o si bloccano a causa dell’aterosclerosi (l’accumulo di placche). Questo riduce il flusso di sangue, causando ischemia, ovvero una mancanza di ossigeno ai tessuti. Pensate che la PAD è la terza causa principale di morbilità cardiovascolare aterosclerotica, dopo le malattie coronariche e l’ictus, e colpisce oltre 200 milioni di persone nel mondo! I sintomi? Dolore camminando (la famosa *claudicatio intermittens*), mobilità ridotta e, nei casi più gravi, necrosi dei tessuti e rischio di amputazione.
Le terapie attuali si concentrano sui fattori di rischio cardiovascolare e, nei casi severi, si ricorre alla chirurgia o a interventi endovascolari. Ma, diciamocelo, queste opzioni non sono sempre efficaci o fattibili per tutti. C’è un bisogno disperato di nuove strategie, specialmente per chi soffre di forme avanzate di PAD.
SDF-1α: Una Promessa per la Rigenerazione Vascolare
Qui entra in gioco la medicina rigenerativa. Una delle molecole più promettenti in questo campo è il fattore derivato dalle cellule stromali-1 (SDF-1), noto anche come CXCL12. Perché è così interessante? Perché gioca un ruolo chiave nel mobilitare le cellule progenitrici endoteliali (EPCs) – le “cellule operaie” che riparano i vasi sanguigni – e nel promuovere la neovascolarizzazione (la formazione di nuovi vasi) nei tessuti ischemici. L’SDF-1 agisce come un segnale di richiamo, guidando le EPCs verso le aree danneggiate.
Il nostro corpo produce naturalmente SDF-1 in risposta all’ischemia, ma spesso questa risposta è troppo debole o di breve durata per riparare completamente i danni. Studi preclinici hanno mostrato che somministrare SDF-1 “dall’esterno” può migliorare l’angiogenesi, ma ci sono dei problemi: la proteina SDF-1 ha una vita breve nel corpo e costa molto produrla. Anche la terapia genica basata su DNA (usando plasmidi per far produrre SDF-1 alle cellule) ha deluso le aspettative negli studi clinici, probabilmente per una bassa efficienza di “consegna” del gene e una produzione insufficiente di proteina.
La Rivoluzione dell’mRNA: Un Nuovo Approccio
E se potessimo dire direttamente alle cellule del paziente di produrre la quantità giusta di SDF-1α (la forma attiva di SDF-1), proprio dove serve e solo per il tempo necessario? Qui entra in gioco la terapia a mRNA! Ricordate i vaccini COVID? Usano proprio questa tecnologia. L’mRNA offre vantaggi enormi:
- Espressione transitoria e controllabile: l’mRNA non si integra nel DNA, dà l’istruzione e poi viene degradato.
- Minore immunogenicità rispetto ad altre terapie geniche.
- Potenziale per una rapida traslazione clinica.
La nostra ipotesi? Che la terapia con mRNA di SDF-1α possa superare i limiti delle terapie precedenti, garantendo un’espressione efficiente della proteina e potenziando la rigenerazione nei tessuti ischemici.
Nanoparticelle Intelligenti: Il Nostro Vettore DOPE-LNP
Ovviamente, l’mRNA da solo fa fatica a entrare nelle cellule. Serve un “veicolo” di consegna. Abbiamo quindi sviluppato delle nanoparticelle lipidiche (LNP) appositamente progettate. Molte LNP approvate usano un lipide chiamato DSPC, ottimo per piccole molecole come gli siRNA, ma meno efficiente per l’mRNA, che è più lungo. Noi abbiamo puntato su un altro lipide, il DOPE (1,2-dioleoil-sn-glicero-3-fosfoetanolammina). Perché? La struttura del DOPE, con doppi legami nelle sue “code”, facilita il rilascio dell’mRNA una volta dentro la cellula. Inoltre, la sua forma “a cono” favorisce la fusione con la membrana cellulare.
Abbiamo testato diverse formulazioni di LNP contenenti DOPE, ottimizzando le proporzioni dei vari lipidi (DLin-MC3-DMA, colesterolo, DOPE e DMG-PEG 2000) per massimizzare l’efficienza di consegna dell’mRNA (abbiamo usato un mRNA reporter, mCherry, per visualizzare la consegna). La nostra formulazione ottimizzata, che abbiamo chiamato LNP-2, ha mostrato un’efficienza significativamente superiore rispetto alle LNP tradizionali con DSPC nel “consegnare” l’mRNA alle cellule endoteliali umane (HUVEC) in coltura. Queste LNP-2 erano piccole (circa 100 nm), stabili nel tempo a 4°C e, cosa fondamentale, non tossiche per le cellule.
Prove di Laboratorio: Cosa Succede alle Cellule?
Una volta messo a punto il nostro “taxi” (le LNP-2 a base di DOPE), lo abbiamo caricato con il nostro passeggero terapeutico: l’mRNA di SDF-1α (chiamando il complesso LNP@SDF-1α). Abbiamo trattato le cellule endoteliali HUVEC con LNP@SDF-1α. I risultati? Fantastici!
- Aumento dell’espressione di SDF-1α: Le cellule trattate producevano e rilasciavano significativamente più proteina SDF-1α rispetto ai controlli. L’espressione ottenuta con l’mRNA era nettamente superiore a quella ottenuta con un plasmide di DNA equivalente.
- Potenziamento dell’angiogenesi in vitro: In un test chiamato “tube formation assay” (dove le cellule endoteliali formano strutture simili a capillari su un gel), le cellule trattate con LNP@SDF-1α formavano reti vascolari molto più sviluppate (più giunzioni, vasi più lunghi).
- Aumento della migrazione cellulare: In un test “scratch assay” (dove si crea un “graffio” in uno strato di cellule e si misura quanto velocemente viene richiuso), le cellule trattate migravano più rapidamente per chiudere la ferita.
- Maggiore adesione di monociti: L’SDF-1α attira anche cellule immunitarie come i monociti, che partecipano alla riparazione. Abbiamo visto che le HUVEC trattate con LNP@SDF-1α legavano più monociti (cellule THP-1, che esprimono il recettore CXCR4 per SDF-1α). Questo effetto veniva bloccato da un antagonista del recettore CXCR4 (AMD3100), confermando che l’effetto era specifico.
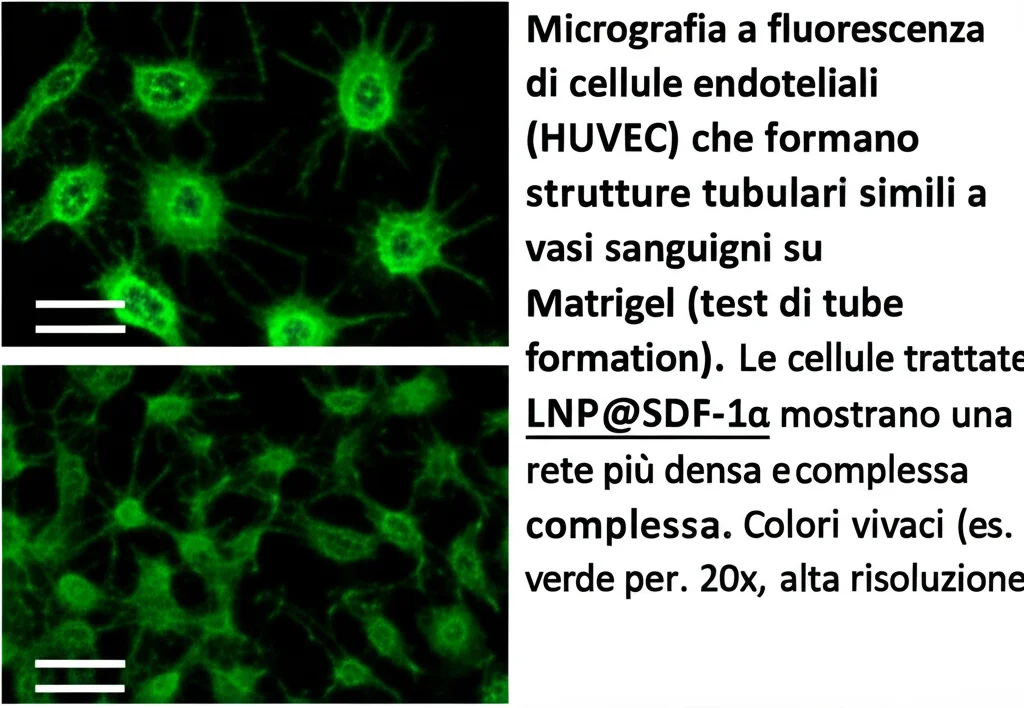
Dal Laboratorio all’Organismo: I Test In Vivo
I risultati in provetta erano incoraggianti, ma la vera prova è nell’organismo vivente. Abbiamo usato due modelli animali.
1. Modello Matrigel Plug: Abbiamo mescolato le HUVEC trattate con LNP@SDF-1α (o LNP di controllo) con Matrigel (una matrice gelatinosa) e le abbiamo iniettate sottocute in topi. Dopo 5 giorni, abbiamo analizzato questi “tappi” di gel. Quelli con le cellule trattate con LNP@SDF-1α erano visibilmente più rossi (più sangue) e l’analisi istologica (colorazione HeE e immunofluorescenza per CD31, un marcatore dei vasi) ha confermato una densità vascolare significativamente maggiore. L’angiogenesi era chiaramente potenziata!
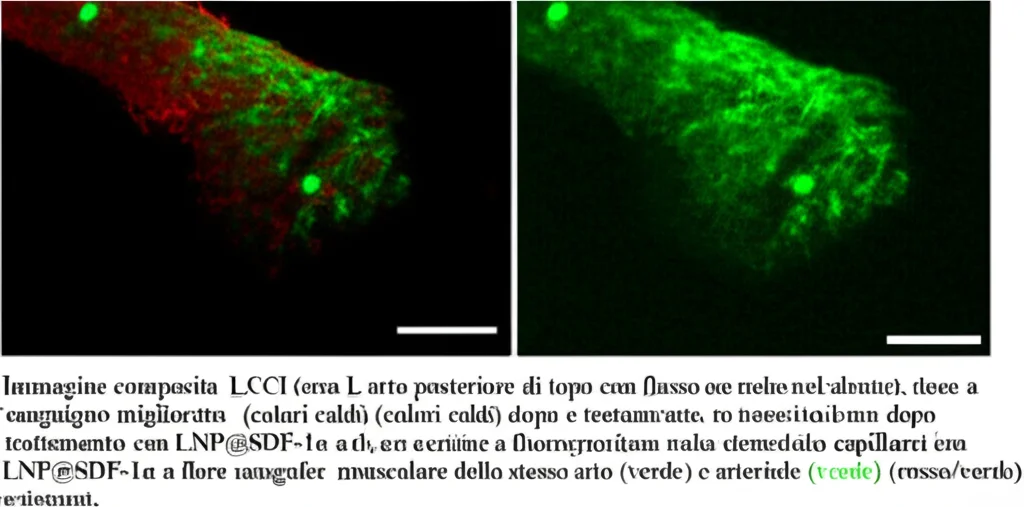
2. Modello di Ischemia dell’Arto Posteriore: Questo modello simula più da vicino la PAD umana. Abbiamo indotto chirurgicamente l’ischemia in una zampa posteriore di topi (legando l’arteria femorale). Subito dopo l’intervento, e di nuovo 3 giorni dopo, abbiamo iniettato LNP@SDF-1α (o LNP di controllo) direttamente nel muscolo ischemico (il gastrocnemio). Abbiamo monitorato il recupero del flusso sanguigno per 21 giorni usando una tecnica chiamata Laser Speckle Contrast Imaging (LSCI).
I risultati sono stati netti:
- Recupero del flusso sanguigno accelerato: I topi trattati con LNP@SDF-1α mostravano un recupero della perfusione sanguigna significativamente più rapido e completo rispetto ai controlli, specialmente dopo 7, 14 e 21 giorni.
- Miglioramento dello stato dell’arto: I topi trattati avevano punteggi significativamente migliori per quanto riguarda la perdita dell’arto e lo stato generale della zampa ischemica (meno necrosi, più salvataggio dell’arto).
- Aumento della densità vascolare: L’analisi istologica dei muscoli a 21 giorni ha rivelato un aumento significativo sia della densità dei capillari (marcati con CD31) sia delle arteriole (marcati con CD31 e α-SMA, un marcatore delle cellule muscolari lisce che circondano le arteriole) nel gruppo trattato con LNP@SDF-1α. Questo indica non solo angiogenesi (nuovi capillari) ma anche arteriogenesi (maturazione e ingrandimento dei vasi).
Abbiamo anche verificato l’espressione genica e proteica nei muscoli trattati. L’mRNA umano di SDF-1α era ancora rilevabile dopo 21 giorni, indicando un’espressione sostenuta. Inoltre, abbiamo osservato un aumento dei livelli di fattori pro-angiogenici endogeni come VEGF e Hif-1α, e un’analisi proteomica ha confermato l’aumento di proteine chiave per l’angiogenesi (Ang-1, HGF, PIGF-2, VEGF, MMP-3) e una diminuzione di fattori anti-angiogenici (Serpin F1).
Sicurezza e Prospettive Future
Un aspetto cruciale è la sicurezza. L’analisi istologica dei principali organi (fegato, milza, reni) dei topi trattati non ha mostrato segni di tossicità, suggerendo un buon profilo di sicurezza sia per le nostre LNP a base di DOPE sia per l’mRNA modificato che abbiamo utilizzato (con pseudouridina e 5-metilcitosina per ridurre l’immunogenicità e aumentare la stabilità).
Cosa ci dicono questi risultati? Che la terapia con mRNA di SDF-1α, veicolata dalle nostre LNP ottimizzate, è una strategia potente per promuovere la rigenerazione vascolare nei tessuti ischemici. Riesce a fare ciò che le terapie precedenti non sono riuscite a fare: fornire una dose efficace e localizzata di SDF-1α, stimolando sia l’angiogenesi che l’arteriogenesi e ripristinando il flusso sanguigno.
Questo approccio è estremamente promettente per il trattamento della PAD, specialmente per i pazienti con ischemia critica dell’arto che hanno poche altre opzioni. Certo, la strada è ancora lunga. Bisognerà valutare gli effetti a lungo termine sulla stabilità dei nuovi vasi e testare l’efficacia in condizioni più complesse, come in presenza di diabete o iperlipidemia, comuni nei pazienti con PAD.
Ma il potenziale è enorme. Abbiamo superato alcuni ostacoli chiave delle terapie precedenti e aperto una nuova strada per la rigenerazione vascolare nelle malattie ischemiche, sfruttando la versatilità e la potenza della tecnologia a mRNA. Continueremo a lavorare su questa frontiera, sperando di portare presto questa speranza più vicino ai pazienti!
Fonte: Springer