TDP-43 Sotto la Lente: Come una Piccola Modifica Chimica Rivela Segreti sull’Auto-Associazione e la SLA
Ciao a tutti, appassionati di scienza e misteri del corpo umano! Oggi voglio parlarvi di una proteina davvero intrigante, un po’ Dr. Jekyll e Mr. Hyde, chiamata TDP-43. Immaginatela come un’instancabile lavoratrice che fa la spola tra il nucleo della cellula e il citoplasma. Nel nucleo, è fondamentale: si associa con altre copie di se stessa per regolare come vengono “letti” i nostri geni, un processo essenziale per la vita della cellula. Fin qui, tutto bene, è la nostra eroina.
Ma ecco il lato oscuro: quando questa proteina finisce nel citoplasma, a volte le cose vanno storte. Invece di fare il suo lavoro, inizia ad aggregarsi in modo anomalo, formando delle strutture chiamate amiloidi. Questi aggregati sono come “grumi” tossici che si accumulano e sono associati a malattie neurodegenerative terribili, come la Sclerosi Laterale Amiotrofica (SLA) e la demenza frontotemporale (FTD). Un bel problema, vero?
La Fosforilazione: Un Interruttore Molecolare Misterioso
Ora, cosa può influenzare questo comportamento ambivalente della TDP-43? Uno dei meccanismi chiave sono le cosiddette modificazioni post-traduzionali. Pensate a delle piccole “decorazioni” chimiche che vengono aggiunte alla proteina dopo che è stata prodotta. Una delle più importanti è la fosforilazione: l’aggiunta di un gruppo fosfato (una piccola molecola carica) in punti specifici della proteina.
Questa fosforilazione può cambiare le carte in tavola, influenzando sia la funzione normale della TDP-43 nel nucleo sia la sua tendenza a diventare “cattiva” e aggregarsi nel citoplasma. Capire esattamente come e dove la fosforilazione agisce è cruciale per comprendere la progressione di malattie come la SLA. Il problema? Studiare l’effetto di una fosforilazione in un punto *preciso* della proteina è incredibilmente difficile. Produrre in laboratorio una proteina TDP-43 completa (che è composta da ben 414 amminoacidi!) con un gruppo fosfato esattamente dove vogliamo noi è una sfida tecnica enorme.
La Semi-Sintesi: L’Arte di “Costruire” Proteine su Misura
Ed è qui che entra in gioco la chimica, con un approccio super affascinante chiamato semi-sintesi. È un po’ come costruire con i LEGO molecolari: si produce una parte della proteina usando metodi biologici (come l’ingegneria genetica in batteri) e un’altra parte, quella che contiene la modifica specifica che ci interessa, la si sintetizza chimicamente in laboratorio, pezzo per pezzo. Poi, con una tecnica chiamata Native Chemical Ligation (NCL), si “cuciono” insieme i due pezzi per ottenere la proteina completa e modificata esattamente come la vogliamo.
Nel lavoro che vi racconto oggi, i ricercatori si sono concentrati su una fosforilazione specifica: quella sulla serina in posizione 48 (che chiameremo pS48), situata nel dominio N-terminale (NTD) della TDP-43. Questa è una modifica interessante perché la maggior parte delle modifiche associate alla SLA si trovano nella parte C-terminale della proteina. Cosa fa di speciale questa pS48 nell’NTD?
Il team ha messo a punto una strategia brillante. Hanno prodotto la parte “grande” della proteina (dal residuo 50 al 414) nei batteri, usando un sistema di purificazione intelligente con un “tag” di affinità (CBD) e un elemento (inteina) che si auto-taglia al cambio di pH. Ottenere questa parte non è stato facile, perché tende ad aggregarsi, ma ce l’hanno fatta! Poi, hanno sintetizzato chimicamente il pezzetto iniziale (dal residuo 1 al 49), inserendo il gruppo fosfato proprio sulla serina 48 e aggiungendo un altro “tag” (un His-tag, una sequenza di istidine) all’inizio.
Hanno quindi unito i due pezzi con la NCL. La reazione non è stata super efficiente, probabilmente a causa della tendenza della parte C-terminale ad aggregare, ma qui arriva il colpo di genio: grazie all’His-tag presente solo sul pezzo N-terminale (e quindi sul prodotto completo dopo la legatura), hanno potuto “pescare” selettivamente la proteina TDP-43 completa e fosforilata (TDP1-414[pS48]) dal miscuglio di reazione usando una colonna di affinità per l’His-tag. Un metodo elegante per ottenere un prodotto puro!
Risultati Sorprendenti: La Fosforilazione S48 Indebolisce l’Auto-Associazione
Una volta ottenuta la nostra TDP-43 fosforilata pura (e anche la sua versione non fosforilata come controllo), è arrivato il momento di vedere cosa combina. Hanno condotto esperimenti per studiare la sua tendenza ad auto-associarsi e aggregare in condizioni fisiologiche (pH neutro, 37°C).
E qui la sorpresa: la TDP-43 con il fosfato in S48 (TDP1-414[pS48]) mostrava una tendenza significativamente minore ad auto-associarsi rispetto alla versione non modificata. In pratica, rimaneva più “solubile” per più tempo. Questo risultato è coerente con studi precedenti che usavano una “mimica” della fosforilazione (sostituendo la serina con un altro amminoacido carico negativamente, il glutammato), ma vederlo con la vera modifica chimica è molto più potente!
Ma non è finita qui. Hanno anche osservato gli aggregati al microscopio elettronico (TEM). La TDP-43 normale, dopo un po’ di tempo, formava le classiche fibrille amiloidi robuste, tipiche delle patologie. Invece, la TDP-43 fosforilata in S48 formava sì degli aggregati, ma erano diversi: grossi ammassi, con diametri superiori ai 100 nm, ma non le tipiche fibrille amiloidi. Una differenza morfologica notevole!

Zoom sul Dominio N-Terminale (NTD): La Chiave è la Repulsione Elettrostatica?
Sappiamo che l’interazione tra i domini N-terminali (NTD) di diverse molecole di TDP-43 è importante per la sua auto-associazione fisiologica nel nucleo. L’ipotesi, quindi, era che il gruppo fosfato in S48, essendo carico negativamente, potesse interferire con questa interazione.
Per verificarlo, hanno sintetizzato chimicamente solo il dominio NTD (i primi 80 amminoacidi), sia nella versione fosforilata (TDP1-80[pS48]) che in quella normale. Analizzando come queste molecole si associano in soluzione (usando tecniche come la SEC, che separa le molecole per dimensione), hanno confermato che l’NTD fosforilato tende a formare aggregati più piccoli rispetto a quello non modificato. Anche esperimenti di crosslinking (che “legano” chimicamente le proteine vicine) hanno mostrato meno prodotti legati tra loro per la versione fosforilata. Quindi, sì, la fosforilazione in S48 indebolisce l’interazione tra i domini NTD.
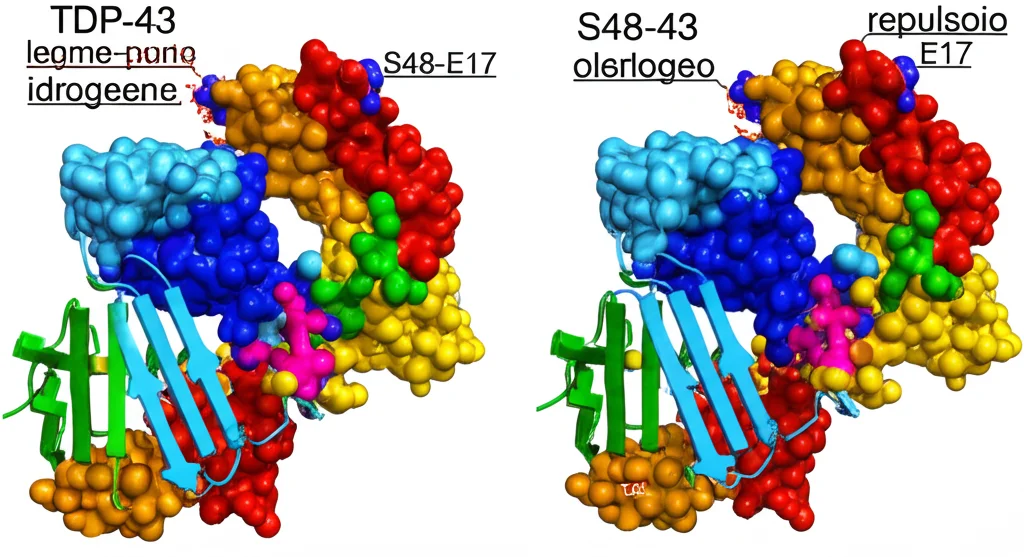
Ma come? Per capirlo, hanno usato una tecnica sofisticata chiamata SEC-SAXS, che combina la separazione per dimensione (SEC) con la diffrazione dei raggi X a piccolo angolo (SAXS) per ottenere informazioni sulla struttura tridimensionale delle molecole in soluzione. Sono riusciti a determinare la struttura del monomero di TDP1-80[pS48]. Confrontandola con la struttura nota del dimero (due unità associate) dell’NTD non fosforilato, hanno notato una differenza cruciale proprio nella zona attorno alla serina 48.
Nella struttura normale, la S48 di un’unità interagisce (tramite un legame idrogeno) con un altro amminoacido carico negativamente, il glutammato 17 (Glu17), dell’altra unità, contribuendo a tenere insieme il dimero in una configurazione “testa-coda”. Nella versione fosforilata, invece, il gruppo fosfato (pS48), che porta due cariche negative, si trova in una posizione tale da non poter formare quel legame idrogeno e, anzi, probabilmente genera una repulsione elettrostatica con il Glu17 (anch’esso negativo). Immaginate due magneti con lo stesso polo che si respingono: ecco, qualcosa di simile potrebbe accadere qui a livello molecolare, impedendo o indebolendo l’associazione tra i domini NTD.
Cosa Significa Tutto Questo per la Malattia?
Questi risultati sono affascinanti e aprono nuovi scenari. Se la fosforilazione in S48 indebolisce l’interazione tra gli NTD, questo potrebbe avere due conseguenze principali:
- Disfunzione nel nucleo: L’auto-associazione fisiologica della TDP-43 nel nucleo è necessaria per la sua funzione nella regolazione dell’RNA. Se questa associazione è più debole, la funzione normale potrebbe essere compromessa.
- Aumento del rischio nel citoplasma: È stato ipotizzato che la TDP-43 dissociata (non associata tramite gli NTD) sia più suscettibile a essere tagliata da enzimi (proteolisi). Questo taglio può liberare frammenti, specialmente dalla regione C-terminale, che sono molto inclini a formare aggregati amiloidi tossici. Quindi, indebolendo l’associazione NTD, la fosforilazione S48 potrebbe indirettamente promuovere la formazione di specie tossiche nel citoplasma, anche se gli aggregati della proteina intera fosforilata sembrano diversi dalle fibrille classiche.
In pratica, questa specifica fosforilazione potrebbe contribuire alla patologia della SLA sia disturbando la funzione normale nel nucleo, sia favorendo percorsi di aggregazione tossica nel citoplasma.
Questo studio è un bellissimo esempio di come la chimica e la biologia strutturale possano unirsi per svelare i meccanismi molecolari alla base delle malattie. La capacità di sintetizzare proteine con modifiche specifiche apre la porta a studi futuri su altre modificazioni post-traduzionali della TDP-43, aiutandoci a comporre il complesso puzzle di queste devastanti malattie neurodegenerative. La ricerca continua, e ogni pezzo che aggiungiamo ci avvicina a una comprensione più profonda e, speriamo, a future terapie.
Fonte: Springer