Talquetamab: Una Nuova Speranza Scintilla per i Pazienti Giapponesi con Mieloma Multiplo!
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi sta davvero a cuore e che sta accendendo una luce di speranza nel mondo dell’oncologia, in particolare per chi combatte contro il mieloma multiplo recidivato/refrattario (RRMM). Immaginate una malattia astuta, che anche dopo i trattamenti standard tende a ripresentarsi. Ecco, il mieloma multiplo è un po’ così, una sfida continua. E in Giappone, questa sfida è particolarmente sentita, con circa 4000 decessi all’anno e un’incidenza in leggera crescita.
Negli ultimi anni, per fortuna, abbiamo assistito a progressi incredibili, con nuove terapie che hanno migliorato la sopravvivenza. Ma, diciamocelo chiaramente, quando la malattia diventa “triplo-refrattaria” – cioè resistente a immunomodulatori, inibitori del proteasoma e anticorpi anti-CD38 – le opzioni si restringono drasticamente e la prognosi non è delle migliori. Serve qualcosa di nuovo, un approccio diverso.
Ecco che Entra in Scena il Talquetamab
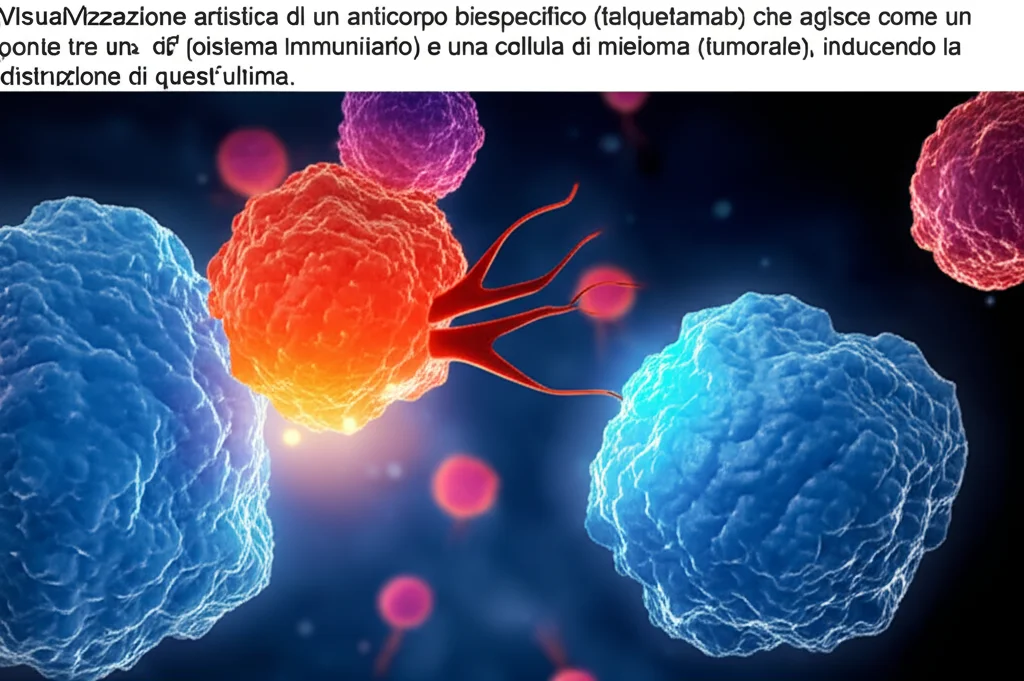
E qui, amici, entra in gioco una molecola dal nome un po’ complesso ma dalle grandi promesse: il talquetamab. Pensatelo come un agente speciale, un anticorpo bispecifico “primo della classe”. Cosa significa? Che ha due “braccia”: una si lega alle cellule T del nostro sistema immunitario (tramite il recettore CD3) e l’altra a un bersaglio specifico presente sulle cellule di mieloma maligno, chiamato GPRC5D. In pratica, il talquetamab fa da ponte, portando le cellule T direttamente a contatto con le cellule tumorali per distruggerle. Un’idea geniale, no?
Lo studio globale MonumenTAL-1 ha già mostrato risultati entusiasmanti con il talquetamab, tanto da portarlo all’approvazione negli Stati Uniti e in Europa per pazienti con RRMM pesantemente pretrattati. Ma la domanda che ci siamo posti è: funzionerà altrettanto bene e sarà altrettanto sicuro anche per i pazienti giapponesi?
Lo Studio Giapponese: Un Tassello Cruciale
Ed è proprio di questo che voglio parlarvi oggi: uno studio di fase 1, multicentrico e in aperto, condotto specificamente su pazienti giapponesi con RRMM che avevano già ricevuto l’arsenale terapeutico standard (inibitore del proteasoma, immunomodulatore e anticorpo anti-CD38). L’obiettivo primario era chiarissimo: valutare la sicurezza e la tollerabilità del talquetamab, inclusa l’eventuale tossicità limitante la dose (DLT). Poi, ovviamente, eravamo super curiosi di vedere i primi segnali di efficacia: il tasso di risposta globale (ORR), la durata della risposta e il tempo necessario per ottenerla.
Nello studio, i pazienti sono stati divisi in tre coorti, ricevendo talquetamab per via sottocutanea a dosaggi differenti:
- Coorte 1: 135 µg/kg settimanalmente (QW)
- Coorte 2: 400 µg/kg settimanalmente (QW)
- Coorte 3: 800 µg/kg ogni due settimane (Q2W)
Quest’ultima coorte, la 3, è stata introdotta in corso d’opera, perché nel frattempo lo studio globale MonumenTAL-1 aveva identificato proprio il dosaggio di 800 µg/kg Q2W come una delle dosi raccomandate per la fase 2 (RP2D), insieme a quella da 400 µg/kg QW. Per minimizzare il rischio di sindrome da rilascio di citochine (CRS), una reazione infiammatoria comune con queste terapie, i pazienti hanno ricevuto dosi “step-up” (crescenti) prima della prima dose piena di trattamento, oltre a premedicazione con glucocorticoidi, antistaminici e antipiretici.

I pazienti arruolati erano adulti, con diagnosi confermata di mieloma multiplo e malattia misurabile, che avevano già provato – e a cui non avevano risposto o avevano avuto una ricaduta – le terapie consolidate. Un gruppo, quindi, particolarmente difficile da trattare.
Risultati di Sicurezza: Un Profilo Gestibile
E veniamo ai risultati, che sono stati presentati con un cutoff dei dati al 9 febbraio 2024. Quindici pazienti hanno ricevuto almeno una dose di talquetamab. La notizia più importante? Nessuna tossicità limitante la dose (DLT) è stata osservata, e non ci sono stati decessi né interruzioni del trattamento o riduzioni di dose a causa di eventi avversi (AEs). Questo è un punto fondamentale!
Gli eventi avversi emergenti dal trattamento (TEAEs) più comuni sono stati:
- Neutropenia (bassi livelli di neutrofili, un tipo di globuli bianchi): 60.0%
- Linfopenia (bassi livelli di linfociti): 53.3%
- Sindrome da Rilascio di Citochine (CRS): 46.7%
È importante sottolineare che tutti gli eventi di CRS sono stati di Grado 1, quindi lievi, e si sono verificati principalmente durante le dosi step-up o alla prima dose del ciclo 1. Sono stati gestiti bene con terapie di supporto, incluso il tocilizumab in alcuni casi. Solo un paziente ha manifestato neurotossicità (insonnia di Grado 1), ma nessun caso di ICANS (sindrome da neurotossicità associata a cellule immunitarie effettrici).
Un aspetto interessante del talquetamab, legato al suo bersaglio GPRC5D, riguarda alcuni TEAEs specifici, tutti di Grado 1 o 2 (quindi lievi o moderati):
- Disgeusia (alterazione del gusto): il più frequente, riscontrato nel 66.7% dei pazienti.
- Tossicità cutanea (pelle secca, esfoliazione, prurito): 33.3%
- Rash cutaneo: 20%
- Disturbi ungueali: 13.3%
- Bocca secca: 6.7%
La disgeusia, sebbene in molti casi non si sia risolta entro il cutoff dei dati, non ha portato a interruzioni del trattamento o modifiche di dose, dimostrandosi clinicamente gestibile. Anzi, il 40% dei pazienti ha visto risolversi questo sintomo, suggerendo che sia reversibile. Questi effetti collaterali sono probabilmente dovuti al fatto che GPRC5D è espresso anche in tessuti sani come le papille filiformi della lingua (che però non hanno recettori del gusto!) e nella zona cheratogena delle unghie.
Efficacia: Il Talquetamab Mantiene le Promesse?
Passiamo ora all’efficacia, il cuore pulsante della ricerca. Con un follow-up mediano complessivo di 9.0 mesi, il tasso di risposta globale (ORR) è stato del 60.0%! Questo significa che 9 pazienti su 15 hanno ottenuto una risposta parziale o migliore. Un risultato davvero notevole, considerando quanto questi pazienti fossero pesantemente pretrattati.
Analizzando le coorti:
- Coorte 1 (135 µg/kg QW): ORR 25.0%
- Coorte 2 (400 µg/kg QW): ORR 60.0%
- Coorte 3 (800 µg/kg Q2W): ORR 83.3%
La Coorte 3, con il dosaggio più alto somministrato ogni due settimane, ha mostrato la risposta più elevata. Una risposta parziale molto buona (VGPR) o migliore è stata ottenuta dal 26.7% dei pazienti totali, e una risposta completa (CR) o migliore dal 13.3%.
La durata mediana della risposta (DOR) complessiva è stata di 7.6 mesi. Per i pazienti che hanno risposto, la probabilità di rimanere in risposta a 6 mesi era del 77.8%. Il tempo mediano per ottenere la prima risposta è stato di soli 1.3 mesi. Questi dati sono davvero incoraggianti e si allineano con quanto osservato nello studio globale MonumenTAL-1.
Un dato particolarmente interessante: un paziente che aveva precedentemente ricevuto una terapia con cellule CAR-T anti-BCMA (un altro tipo di immunoterapia avanzata) e che è stato trattato con talquetamab alla dose RP2D, ha ottenuto una risposta completa durata ben 16.8 mesi! Questo suggerisce che colpire un antigene diverso come GPRC5D potrebbe essere una strategia vincente anche per pazienti che hanno fallito precedenti terapie mirate contro BCMA.
Cosa Ci Dice Tutto Questo?
Beh, per me è un messaggio forte e chiaro. Questo studio di fase 1, sebbene condotto su un numero limitato di pazienti giapponesi, ha dimostrato che il talquetamab ha un profilo di sicurezza accettabile e mostra risultati di efficacia promettenti in pazienti con RRMM pesantemente pretrattati, inclusi quelli refrattari alle tre principali classi di farmaci. Non sono emersi nuovi segnali di allarme per la sicurezza specifici per la popolazione giapponese, e gli eventi avversi sono risultati gestibili.
Certo, ci sono delle limitazioni: il piccolo numero di pazienti in ciascuna coorte e la natura dello studio a braccio singolo rendono difficili confronti diretti con altri farmaci. Saranno necessarie ulteriori valutazioni su un numero maggiore di pazienti giapponesi e con un follow-up più lungo per confermare questi risultati. E la buona notizia è che uno studio giapponese di fase 2, parte del MonumenTAL-1 globale, è già in corso per valutare più a fondo l’efficacia e la sicurezza del talquetamab, includendo anche la qualità della vita dei pazienti.
In conclusione, credo che il talquetamab si stia profilando come una nuova, importante freccia al nostro arco nella lotta contro il mieloma multiplo. I risultati ottenuti sui pazienti giapponesi sono in linea con quelli della popolazione globale e supportano il suo potenziale come nuovo standard di cura. È un altro passo avanti, un’altra speranza concreta per chi affronta questa difficile malattia. E noi, continueremo a seguire con trepidazione i prossimi sviluppi!
Fonte: Springer