Synaptotagmin-1: L’Inaspettata Guardiana del Nostro Cuore Sotto Stress
Ciao a tutti! Oggi voglio parlarvi di una scoperta che mi ha davvero affascinato, qualcosa che riguarda il nostro motore vitale, il cuore, e una proteina dal nome un po’ complesso: la Synaptotagmin-1, o SYT1 per gli amici. Magari l’avete sentita nominare in relazione al cervello, ai neuroni, alla comunicazione tra cellule nervose… ma nel cuore? Sembra strano, vero? Eppure, sembra proprio che questa proteina giochi un ruolo cruciale, e per certi versi sorprendente, anche lì.
Il Cuore Sotto Pressione: Un Problema Diffuso
Partiamo da un problema ben noto: l’ipertrofia cardiaca. In parole semplici, è quando il muscolo cardiaco si ingrossa, spesso come risposta a uno stress continuo, come la pressione alta (ipertensione) o altre malattie cardiovascolari. Potrebbe sembrare una buona cosa, un muscolo più grosso è più forte, no? Purtroppo, non è così semplice. Un cuore ipertrofico è un cuore affaticato, meno efficiente, che lavora male. È una condizione che, se non gestita, può portare a conseguenze serie come lo scompenso cardiaco e persino la morte improvvisa. Capire i meccanismi molecolari dietro l’ipertrofia è fondamentale per trovare nuove terapie, perché diciamocelo, quelle attuali non sono sempre risolutive.
Entra in Scena SYT1: Una Proteina dai Molti Volti
Ed è qui che entra in gioco la nostra SYT1. Come accennavo, è famosa per il suo ruolo nell’esocitosi, quel processo fondamentale con cui le cellule rilasciano sostanze all’esterno, tipo i neurotrasmettitori nel cervello. Ma le sue funzioni non si fermano lì. Studi recenti l’hanno collegata anche alla regolazione dell’apoptosi, la morte cellulare programmata. In alcuni contesti, come nel sistema nervoso o in certi tipi di cancro, SYT1 sembra avere un effetto protettivo, riducendo la morte cellulare. Ma nel cuore? Nessuno lo sapeva con certezza. E visto che l’apoptosi dei cardiomiociti (le cellule muscolari del cuore) è un fattore chiave nel passaggio dall’ipertrofia allo scompenso, la domanda sorgeva spontanea: che ruolo gioca SYT1 in questo scenario?
L’Esperimento: Cosa Succede Quando il Cuore è Sotto Stress?
Per capirci qualcosa di più, i ricercatori hanno fatto quello che fanno meglio: esperimenti! Hanno usato dei topolini, inducendo in loro un’ipertrofia cardiaca simile a quella causata dalla pressione alta cronica negli umani. Questa tecnica si chiama costrizione aortica trasversa (TAC): in pratica, si stringe un po’ l’aorta, costringendo il cuore a pompare contro una resistenza maggiore. Hanno poi osservato cosa succedeva all’espressione di SYT1 nel cuore di questi topolini stressati. E qui la prima sorpresa: i livelli di SYT1 aumentavano significativamente nei cuori ipertrofici rispetto ai cuori sani! Lo stesso risultato è stato ottenuto in vitro, usando cellule cardiache (le H9C2) stimolate con Angiotensina II (Ang II), una sostanza nota per indurre ipertrofia. Addirittura, analizzando dati da cuori umani (dal database GEO GSE1145), si è vista la stessa tendenza: più SYT1 nei cuori malati rispetto a quelli sani. Sembrava quasi che il cuore, sotto stress, cercasse di produrre più SYT1. Ma perché? Era un tentativo di difesa o parte del problema?

La Prova del Nove: Cosa Accade Senza (o con Meno) SYT1?
Per rispondere a questa domanda, bisognava fare il passo successivo: vedere cosa succedeva se SYT1 era carente. I ricercatori hanno usato topolini geneticamente modificati per avere meno SYT1 (tecnicamente, Syt1+/- , perché la mancanza totale è letale). Questi topolini, in condizioni normali, stavano benissimo. Ma quando sono stati sottoposti alla stessa procedura TAC… apriti cielo! Il quadro era decisamente peggiore rispetto ai topolini normali sottoposti a TAC.
Ecco cosa hanno osservato nei topolini con meno SYT1:
- Ipertrofia più grave: Il cuore si ingrossava di più.
- Disfunzione cardiaca accentuata: La capacità del cuore di pompare sangue (misurata con parametri come LVEF e LVFS) era significativamente ridotta.
- Maggiore fibrosi: Il tessuto cardiaco presentava più cicatrici (fibrosi), che lo rendono più rigido e meno funzionale.
- Più apoptosi: Un numero maggiore di cellule cardiache andava incontro a morte programmata.
Risultati simili sono stati ottenuti anche in vitro: silenziando il gene SYT1 nelle cellule H9C2, l’ipertrofia e l’apoptosi indotte da Ang II erano aggravate. Insomma, tutti gli indizi puntavano nella stessa direzione: la carenza di SYT1 peggiorava la situazione. Questo suggeriva fortemente che SYT1 avesse un ruolo protettivo contro l’ipertrofia cardiaca indotta da sovraccarico di pressione. Incredibile, vero? Una proteina nota per altro, che si rivela una sorta di guardiana del cuore.
Il Meccanismo: La Pista della p38 MAPK
Ma come fa SYT1 a proteggere il cuore? I ricercatori hanno iniziato a indagare sui meccanismi molecolari, concentrandosi su una via di segnalazione cellulare nota per essere coinvolta nell’ipertrofia e nell’apoptosi cardiaca: la via delle MAP chinasi (MAPK). Questa famiglia di proteine include diversi membri, tra cui p38, ERK e JNK. Sappiamo che la p38 MAPK, in particolare, quando viene attivata (fosforilata), promuove l’apoptosi e contribuisce all’ipertrofia. Ebbene, cosa hanno scoperto? Nei topolini con meno SYT1 sottoposti a TAC, i livelli di p38 MAPK attivata (fosforilata) erano significativamente più alti rispetto ai topolini normali sottoposti a TAC! Lo stesso è stato visto nelle cellule H9C2: silenziando SYT1, l’attivazione di p38 indotta da Ang II era potenziata. Interessante notare che gli altri membri della famiglia MAPK (ERK e JNK) non mostravano differenze significative legate alla carenza di SYT1. Sembrava proprio che SYT1 esercitasse il suo effetto protettivo tenendo a bada specificamente l’attivazione della via p38 MAPK.
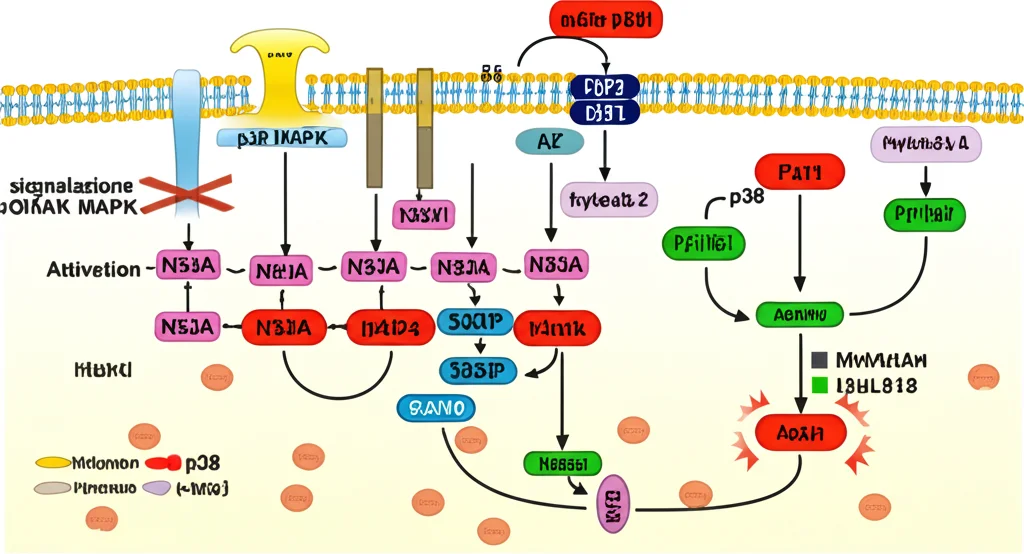
La Conferma Finale: Bloccare p38 Aiuta?
Per essere sicuri che la via p38 MAPK fosse davvero il collegamento mancante, hanno fatto un ultimo esperimento cruciale in vitro. Hanno preso le cellule H9C2 in cui avevano silenziato SYT1 (quelle che peggioravano con Ang II) e le hanno trattate con un inibitore specifico della p38 MAPK (una molecola chiamata SB203580). Il risultato? L’inibitore riusciva ad alleviare l’ipertrofia e l’apoptosi aggravate dalla mancanza di SYT1! In pratica, bloccando p38 a valle, si annullava l’effetto negativo della carenza di SYT1. Questa è stata la conferma: SYT1 protegge il cuore dallo stress da sovraccarico almeno in parte proprio impedendo un’eccessiva attivazione della via p38 MAPK.
Cosa Significa Tutto Questo per Noi?
Questa ricerca apre scenari davvero interessanti. Abbiamo scoperto un ruolo nuovo e protettivo per SYT1 nel contesto dell’ipertrofia cardiaca. Non è più solo una proteina del cervello, ma una potenziale alleata del nostro cuore. Capire che la sua carenza peggiora la malattia attraverso la via p38 MAPK ci dà un doppio bersaglio potenziale per future terapie: potremmo pensare a strategie per aumentare o mantenere i livelli di SYT1 nel cuore sotto stress, oppure potremmo agire più a valle, modulando l’attività di p38 MAPK in modo più mirato. Certo, la strada è ancora lunga, siamo ancora a livello di ricerca pre-clinica su modelli animali e cellulari, ma è un passo avanti importante nella comprensione di questa complessa patologia. È affascinante vedere come il nostro corpo abbia meccanismi di difesa così intricati e come la ricerca continui a svelarli, un pezzetto alla volta. Chissà quali altre sorprese ci riserva lo studio di SYT1 e del nostro meraviglioso cuore!
Fonte: Springer