Cancro e DNA: Svelato l’Interruttore Segreto che Resiste alla Radioterapia!
Amici della scienza, preparatevi! Oggi vi racconto una storia incredibile che si svolge nel cuore più intimo delle nostre cellule, una storia che intreccia DNA danneggiato, cancro e una sorprendente danza molecolare che potrebbe rivoluzionare le terapie antitumorali. Parliamo di come le cellule tumorali riescono, a volte troppo bene, a sopravvivere ai nostri tentativi di eliminarle, in particolare alla radioterapia.
Il Problema della Resistenza: Quando il Cancro Non si Arrende
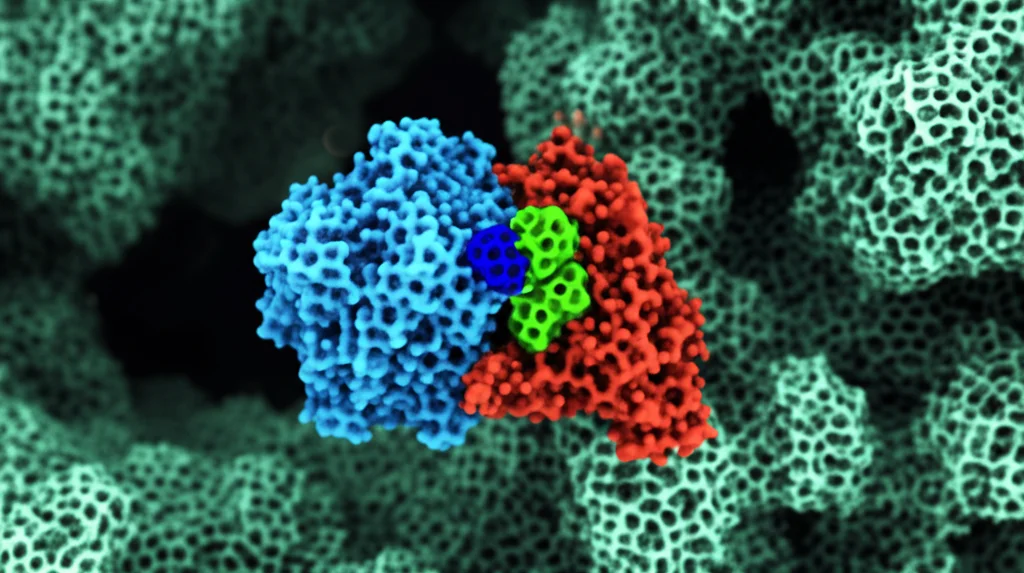
Uno dei più grandi ostacoli nella lotta contro il cancro è la chemio- e radioresistenza. In pratica, bombardiamo il tumore con radiazioni o farmaci per danneggiare il suo DNA e ucciderlo, ma lui, testardo, riesce a riparare i danni e a continuare a crescere. Questo non solo rende le cure meno efficaci, ma aumenta anche la mortalità dei pazienti. Il DNA subisce continuamente danni, ma la rottura del doppio filamento (Double-Strand Break, DSB) è la più grave, quella che la radioterapia cerca di indurre massicciamente. Le nostre cellule, però, hanno meccanismi sofisticati per riparare questi DSB, e uno dei principali si chiama Non-Homologous End Joining (NHEJ). Al centro di questo processo c’è un complesso proteico chiamato DNA-PK. E qui entra in gioco la nostra protagonista: la proteina Ku80.
La Scoperta: Un Interruttore Molecolare Vitale
Ku80, insieme alla sua compagna Ku70, è come un “sensore” che riconosce subito le estremità rotte del DNA. Si lega lì e recluta un’altra proteina, la DNA-PKcs, formando il complesso DNA-PK completo, pronto a dare il via alle riparazioni. Ma come viene assemblato e attivato esattamente questo complesso? Qui stava il mistero. Grazie a tecniche avanzate di proteomica quantitativa, abbiamo “spiato” cosa succede alle proteine dopo l’irradiazione e abbiamo notato qualcosa di strano su Ku80. In particolare, su un suo specifico “mattoncino”, un amminoacido chiamato lisina in posizione 568 (K568). Normalmente, questa lisina K568 porta una modifica chimica chiamata crotonilazione (K568cr), aggiunta da un enzima chiamato PCAF. Ma dopo il danno al DNA indotto dalle radiazioni, questa crotonilazione diminuisce drasticamente!
Come Funziona Questo ‘Switch’? Da Crotonilazione a SUMOilazione
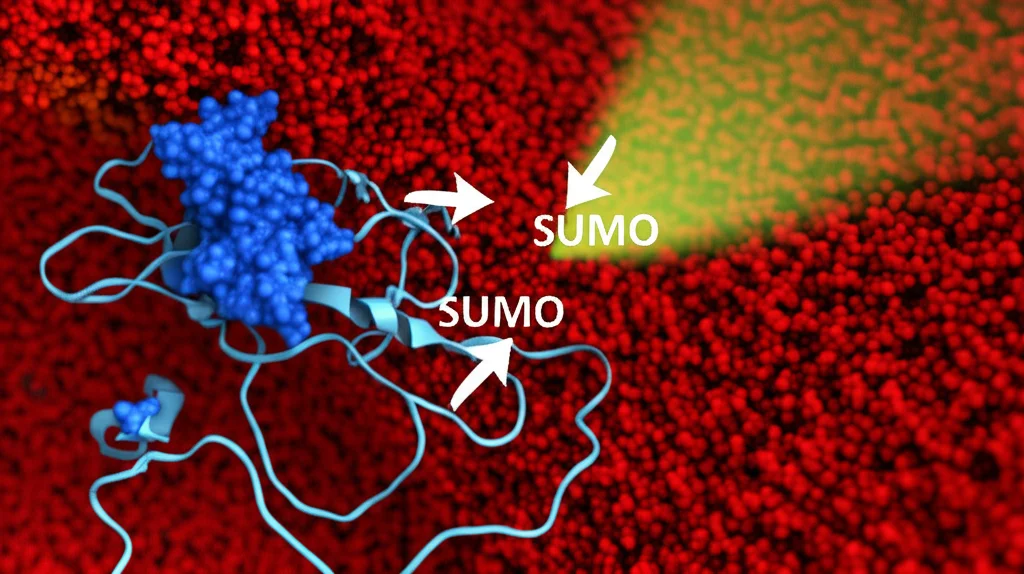
Abbiamo scoperto che un altro enzima, chiamato HDAC8 (una deacetilasi istonica, che però qui agisce come decrotonilasi), si attiva dopo il danno e rimuove il gruppo crotonile da K568. Ma la cosa affascinante è che questo “sgombero” non lascia il sito K568 vuoto. Anzi, lo prepara per un’altra modifica! Appena la crotonilazione se ne va, un altro enzima, CBX4, attacca allo stesso sito K568 una diversa molecola, chiamata SUMO. Si verifica quindi una vera e propria conversione: la crotonilazione viene sostituita dalla SUMOilazione.
Questo “switch” non è un dettaglio da biochimici pignoli, è fondamentale! Abbiamo visto che proprio questa conversione da crotonilazione a SUMOilazione facilita l’assemblaggio del complesso DNA-PK. Non solo: la SUMOilazione di K568 è necessaria per l’attivazione di DNA-PKcs, in particolare per la sua autofosforilazione su un altro sito chiave (S2056), che è il segnale definitivo per iniziare la riparazione NHEJ. In pratica:
- Condizioni normali: Ku80 K568 è crotonilata (da PCAF). Il sistema di riparazione è “in attesa”.
- Danno al DNA (es. radioterapia): HDAC8 rimuove la crotonilazione.
- Subito dopo: CBX4 aggiunge SUMO allo stesso sito K568.
- Conseguenza: Il complesso DNA-PK si assembla meglio e si attiva (fosforilazione di DNA-PKcs S2056).
- Risultato: La riparazione NHEJ parte a pieno regime.
L’Importanza per la Lotta al Cancro
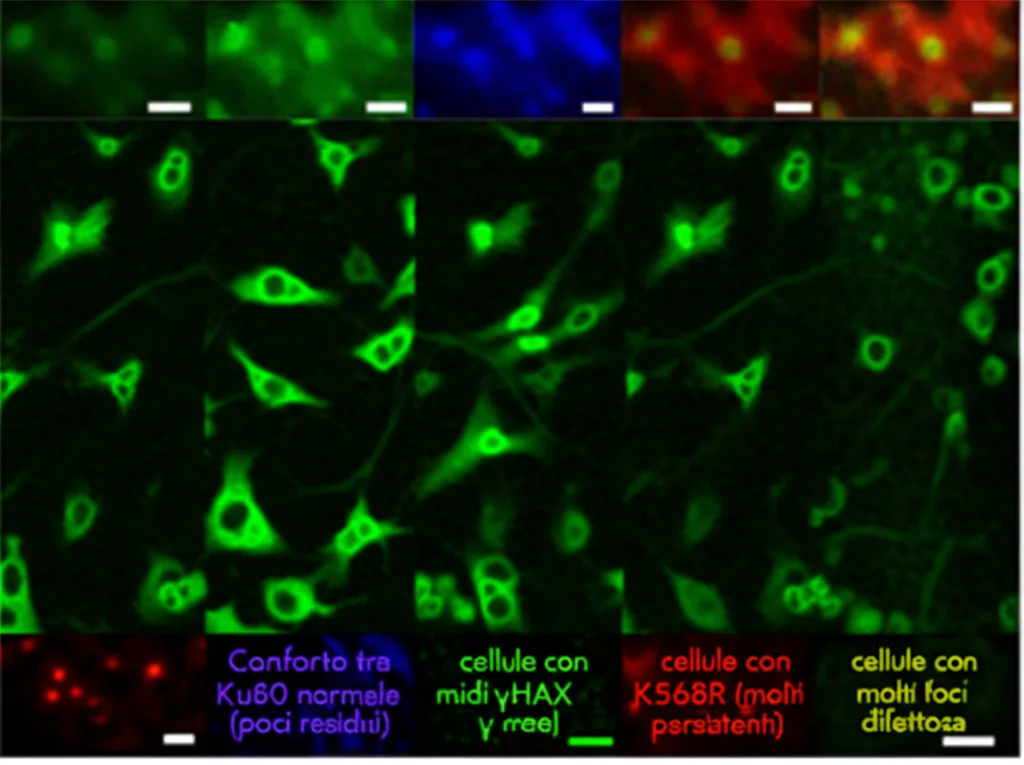
Capite ora perché le cellule tumorali resistenti sono così efficienti? Hanno questo meccanismo di switch ben oliato che permette loro di riparare velocemente i danni indotti dalla terapia. Ma cosa succederebbe se riuscissimo a bloccare questo interruttore? Abbiamo provato a farlo in laboratorio. Abbiamo creato cellule tumorali con una versione mutata di Ku80, dove la lisina K568 è sostituita da un altro amminoacido (arginina, K568R), impedendo così sia la crotonilazione che la SUMOilazione in quel punto. Il risultato? Queste cellule sono diventate molto più sensibili alla radioterapia! La riparazione del DNA era difettosa, i danni si accumulavano e le cellule morivano più facilmente. Abbiamo visto un aumento dei marcatori di danno al DNA (i cosiddetti foci γ-H2AX) e un maggior tasso di apoptosi (morte cellulare programmata) dopo l’irradiazione. Non solo, queste cellule mutanti crescevano meno e formavano meno colonie.
Abbiamo anche testato l’effetto su modelli animali (topi nude con tumori). I tumori derivati dalle cellule con Ku80 mutata (K568R) crescevano più lentamente e rispondevano molto meglio alla radioterapia rispetto ai tumori con Ku80 normale. Questo suggerisce che bloccare lo switch K568 potrebbe essere una strategia vincente per aumentare l’efficacia delle terapie esistenti.
Bloccare l’Interruttore: Una Nuova Speranza?
La scoperta più entusiasmante è forse legata all’enzima HDAC8, quello che rimuove la crotonilazione per far posto alla SUMOilazione. Esistono già farmaci inibitori specifici per HDAC8, come il PCI-34051. Abbiamo testato questo inibitore sulle cellule tumorali. Come previsto, bloccando HDAC8, la crotonilazione di K568 rimaneva alta anche dopo l’irradiazione, e di conseguenza la SUMOilazione non poteva avvenire. Questo, a sua volta, impediva l’attivazione di DNA-PKcs e bloccava la riparazione del DNA. Le cellule trattate con l’inibitore di HDAC8 diventavano più sensibili alle radiazioni! Abbiamo confermato questi risultati in diverse linee cellulari tumorali (non solo HeLa, ma anche A549, HepG2, U87, MCF-7) e persino in modelli di xenotrapianto derivati da pazienti (PDX) con tumori polmonari e meningiomi. La combinazione di radioterapia e inibitore di HDAC8 ha mostrato una riduzione più marcata della crescita tumorale rispetto ai trattamenti singoli.
Questo apre scenari terapeutici davvero promettenti. Invece di cercare farmaci completamente nuovi, potremmo usare inibitori di HDAC8 (o magari in futuro inibitori di CBX4 o modulatori di PCAF specifici per questo processo) per “spegnere” la capacità del tumore di riparare i danni indotti dalla radioterapia o da alcuni chemioterapici che agiscono sul DNA (come etoposide, camptotecina, mitomicina C, idrossiurea, per i quali abbiamo visto una maggiore sensibilità nelle cellule K568R). Sarebbe come togliere lo scudo al nemico prima di attaccarlo.
Conclusioni e Prospettive Future
Quello che abbiamo scoperto è un meccanismo affascinante e finora sconosciuto: uno “switch” dinamico tra due diverse modifiche post-traduzionali (crotonilazione e SUMOilazione) sullo stesso sito (K568) della proteina Ku80, che regola finemente l’inizio della riparazione del DNA più pericoloso. Questo non solo ci aiuta a capire meglio perché alcuni tumori resistono alle terapie, ma ci indica anche nuovi bersagli molecolari per colpirli. La possibilità di usare inibitori di HDAC8 per sensibilizzare i tumori alla radioterapia è particolarmente eccitante e merita ulteriori indagini, magari anche studi clinici. Certo, la strada è ancora lunga. Dobbiamo capire se ci sono altri siti di crotonilazione su Ku80, come questo switch interagisce con altre modifiche e vie di segnalazione, e validare questi risultati in contesti clinici più ampi. Ma aver identificato questo interruttore molecolare è un passo avanti fondamentale. È la dimostrazione che scavare nei dettagli più minuti della biologia cellulare può portare a scoperte con un impatto potenzialmente enorme sulla salute umana. Continueremo a indagare, perché capire questi meccanismi è la chiave per sviluppare terapie sempre più efficaci e personalizzate contro il cancro. Restate sintonizzati!
Fonte: Springer