Batterie al Sodio: La Svolta Arriva da un Pizzico di Litio!
Ragazzi, parliamoci chiaro: le batterie al sodio (SIB, Sodium-Ion Batteries) sono sulla bocca di tutti. E a ragione! Il sodio è abbondante, costa poco… insomma, la base perfetta per l’accumulo di energia su larga scala, magari per le nostre reti elettriche o per dispositivi più accessibili. C’è solo un “ma”, un piccolo dettaglio che finora ha frenato gli entusiasmi: la loro durata e stabilità non sono ancora al top, soprattutto se paragonate alle loro cugine più famose, le batterie agli ioni di litio (LIB). Ma se vi dicessi che forse abbiamo trovato un “ingrediente segreto”, preso proprio in prestito dal mondo del litio, che potrebbe cambiare le carte in tavola? Tenetevi forte, perché sto per raccontarvi come un pizzico di un particolare sale di litio stia facendo miracoli.
Il Cuore del Problema: Interfacce Instabili
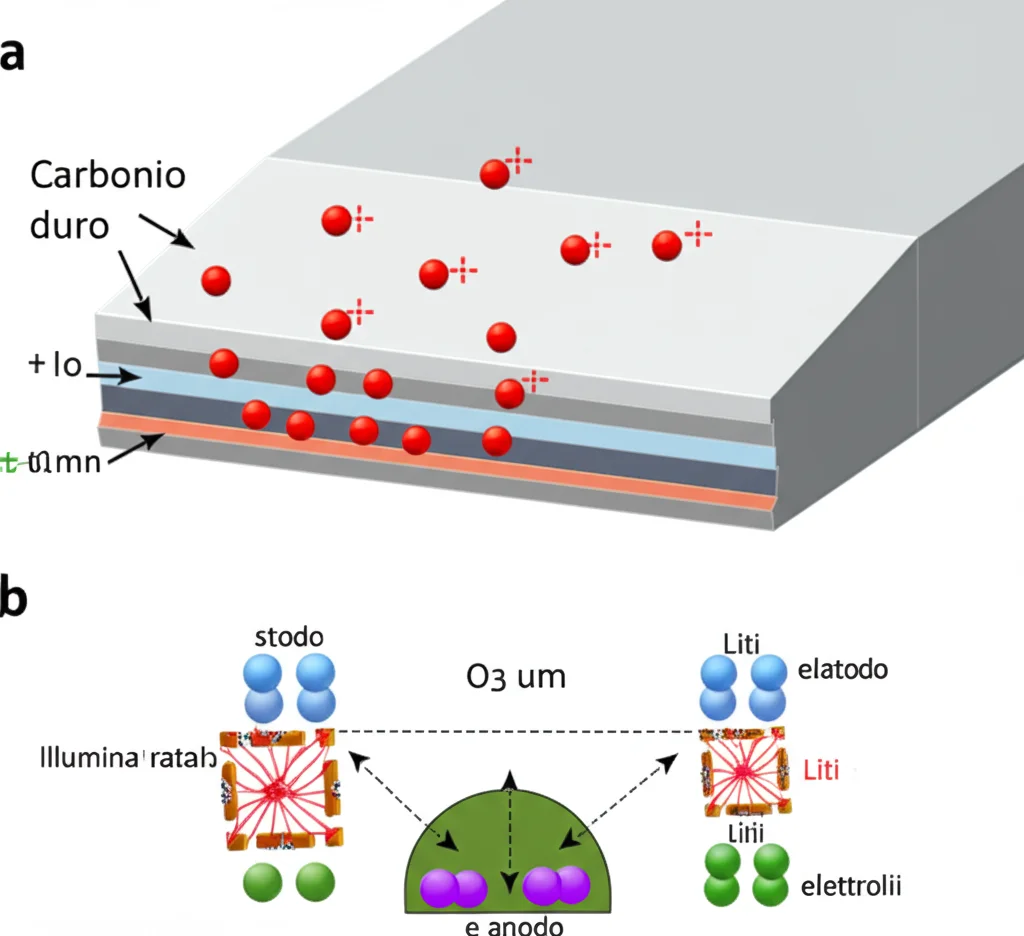
Il vero tallone d’Achille delle batterie al sodio risiede nelle interfacce. Immaginatele come le zone di frontiera tra gli elettrodi (il polo positivo, spesso un ossido stratificato di tipo O3, e quello negativo, di solito carbonio duro) e l’elettrolita (il liquido che permette agli ioni di muoversi). Durante i cicli di carica e scarica, queste zone sono teatro di reazioni chimiche non proprio desiderate.
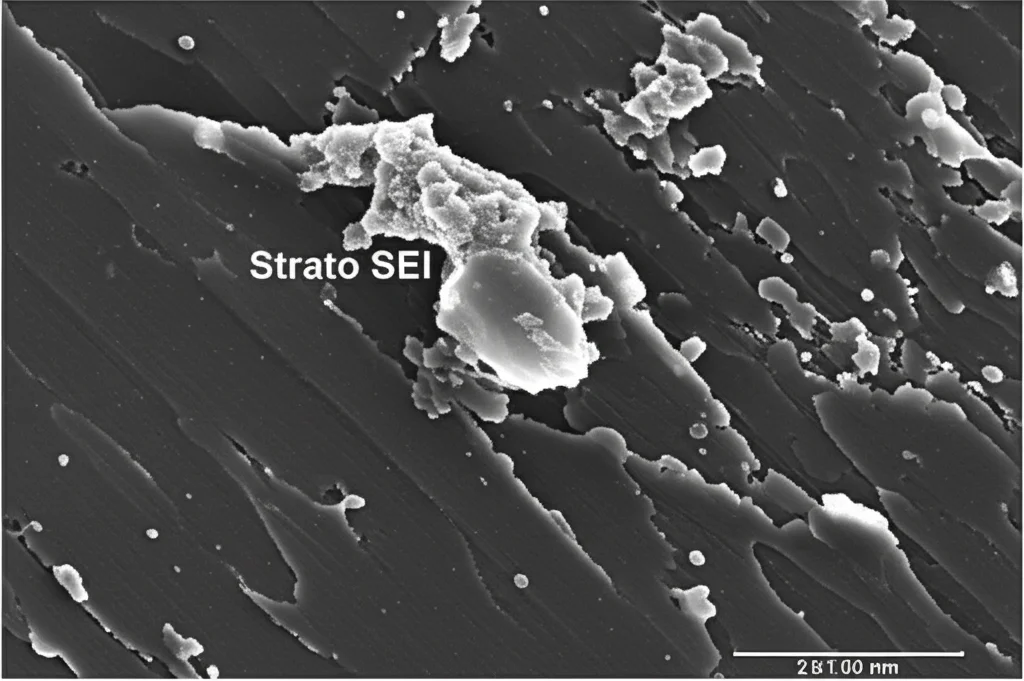
Sull’elettrodo negativo (anodo), si forma uno strato chiamato SEI (Solid Electrolyte Interphase). Nelle batterie al litio, questo strato è fondamentale: una volta formato bene, protegge l’elettrodo e garantisce lunga vita alla batteria. Nelle batterie al sodio, però, la faccenda è più complicata:
- La formazione del SEI è più “difficile”, sia termodinamicamente che cineticamente.
- Il SEI a base di sodio tende ad essere più solubile nell’elettrolita rispetto a quello a base di litio, quindi meno stabile nel tempo.
Questo significa che l’elettrolita continua a decomporsi, consumando ioni sodio e riducendo l’efficienza e la durata della batteria.
Sull’elettrodo positivo (catodo), le cose non vanno molto meglio. Gli ioni sodio, essendo più “ingombranti” degli ioni litio, stressano la struttura cristallina del materiale durante l’inserimento e l’estrazione (intercalazione/deintercalazione). Questo può portare a micro-fratture, al rilascio di ossigeno (che genera gas indesiderati) e a un rapido calo della capacità.
Insomma, per far fare il salto di qualità alle batterie al sodio, dobbiamo trovare un modo per rinforzare entrambe queste interfacce contemporaneamente. Finora si sono usati additivi come il FEC (fluoroetilene carbonato), ma con risultati non ancora ottimali per un utilizzo a lungo termine.
L’Idea “Luminosa”: Aggiungere un Tocco di Litio
Ed ecco la nostra intuizione, studiata a fondo nel lavoro pubblicato su Springer Nature (trovate il link alla fine!): aggiungere una quantità minima, parliamo dello 0.2 M, di esafluorofosfato di litio (LiPF6) – un sale comunissimo nelle batterie al litio – all’elettrolita standard delle batterie al sodio (che contiene NaPF6). Sembra controintuitivo, vero? Aggiungere litio in una batteria al sodio? Eppure, i risultati sono stati sorprendenti.
Magia sull’Anodo: Un SEI a Prova di Bomba
Cosa succede quando aggiungiamo quel pizzico di LiPF6? Succede che la presenza degli ioni litio cambia il modo in cui gli ioni positivi (cationi) interagiscono con le molecole del solvente (l’elettrolita, tipicamente una miscela di carbonati come EC/DMC). Gli studi (come le analisi LUMO e voltammetriche) ci dicono che i “grappoli” di solvente che si formano attorno agli ioni litio (Li-EC) sono più facili da ridurre chimicamente rispetto a quelli attorno agli ioni sodio (Na-EC).
Questo significa che la formazione del SEI sull’anodo di carbonio duro diventa più rapida ed efficiente. Ma non solo! Il SEI che si forma contiene anche composti a base di litio (come Li2CO3). E qui sta il bello: questi composti sono meno solubili nell’elettrolita rispetto ai loro equivalenti a base di sodio. In pratica, creiamo uno strato protettivo (SEI) che:
- Si forma più facilmente.
- È chimicamente più stabile e resistente alla dissoluzione.
- Passiva meglio la superficie dell’anodo, impedendo ulteriori reazioni indesiderate e “fughe” di ioni sodio ed elettroni.
Lo abbiamo visto chiaramente con tecniche come l’EQCM (che misura la massa depositata sull’elettrodo), l’XPS (che analizza la composizione chimica superficiale) e il ToF-SIMS (che mappa la distribuzione degli elementi in 3D): con il LiPF6 si forma più SEI, e questo SEI contiene litio, specialmente negli strati più interni, rendendolo più robusto.
Miracolo sul Catodo: Pilastri di Stabilità e Meno Gas
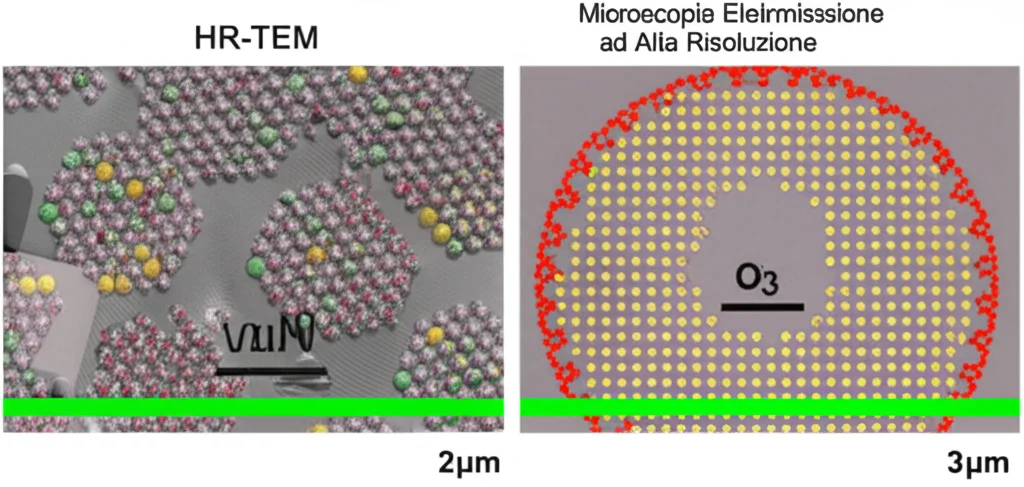
E sull’elettrodo positivo O3? Anche qui il LiPF6 fa la differenza. Durante i primissimi cicli di formazione della batteria, una piccola quantità di ioni litio riesce a intercalarsi superficialmente nella struttura dell’ossido, prendendo il posto di alcuni ioni sodio.
Perché è importante? Perché questi ioni litio, più piccoli e legati più saldamente, agiscono come dei veri e propri “pilastri” strutturali. Immaginate che puntellino l’edificio cristallino, rendendolo più resistente allo stress causato dal viavai degli ioni sodio più grandi. Questo ha due effetti benefici principali:
- Riduce il collasso strutturale e la migrazione degli ioni metallici di transizione, che sono causa di degrado.
- Mitiga drasticamente il rilascio di ossigeno dalla superficie del catodo, che è una delle cause principali della formazione di gas (come CO2) e dell’aumento della pressione interna della cella.
In più, sulla superficie si forma anche un sottile strato di fluoruro di litio (LiF), un altro composto noto per le sue proprietà passivanti, che offre un’ulteriore protezione contro la decomposizione dell’elettrolita ad alte tensioni.
Le analisi lo confermano: l’EELS (una tecnica legata alla microscopia elettronica) ha mostrato la presenza di litio negli strati superficiali del catodo O3. L’XPS ha rilevato sia il litio intercalato che il LiF. E, soprattutto, le misure DEMS (spettrometria di massa elettrochimica differenziale) hanno quantificato una significativa riduzione dell’evoluzione di CO2 durante la carica ad alta tensione nelle celle con LiPF6 rispetto a quelle senza o con solo FEC.
La Prova del Nove: I Test sulla Cella Completa
Ok, la teoria è affascinante, ma funziona davvero in una batteria completa? Abbiamo assemblato delle celle a tasca (pouch cell) con anodo in carbonio duro e catodo O3, usando l’elettrolita standard additivato o con FEC o con il nostro LiPF6, e le abbiamo messe sotto torchio per centinaia di cicli di carica/scarica.
I risultati? Sbalorditivi.
- Le celle con l’additivo standard FEC hanno mostrato una ritenzione della capacità del 73.1% dopo 400 cicli. Non male, ma si può fare di meglio.
- Le celle con il nostro “pizzico” di LiPF6 hanno raggiunto una ritenzione della capacità del 92.7% dopo 400 cicli! Un miglioramento enorme, che supera molti risultati riportati finora in letteratura per questa configurazione.
Non solo la capacità si è mantenuta alta, ma anche la tensione operativa è rimasta molto più stabile nel tempo con il LiPF6, segno che le reazioni parassite e l’aumento della resistenza interna erano state efficacemente contrastate. L’efficienza Coulombica (quanto della carica immessa viene restituita in scarica) è risultata anch’essa superiore.
Le analisi post-mortem delle celle dopo i 400 cicli hanno confermato visivamente quello che sospettavamo:
- Sugli anodi ciclati con FEC si vedevano depositi spessi, segno di continua decomposizione dell’elettrolita. Con LiPF6, la superficie era molto più “pulita”, protetta dal SEI stabile formato all’inizio.
- Sui catodi ciclati con FEC si notava un degrado superficiale più marcato (con formazione di fasi indesiderate tipo spinello, visibili in HR-TEM e FFT). Con LiPF6, la struttura stratificata O3 era incredibilmente ben preservata, grazie all’effetto stabilizzante dei “pilastri” di litio e dello strato di LiF.
Un Futuro Brillante per le Batterie al Sodio?
Quindi, cosa ci portiamo a casa da questa ricerca? Che l’aggiunta strategica di una piccola quantità di LiPF6 nell’elettrolita delle batterie al sodio con configurazione carbonio duro/catodo O3 agisce come un vero e proprio “toccasana” su due fronti:
- Crea un SEI più robusto e stabile sull’anodo, bloccando la decomposizione continua dell’elettrolita.
- Stabilizza la superficie del catodo tramite l’intercalazione superficiale di Li (“effetto pilastro”) e la formazione di LiF, riducendo il degrado strutturale e la produzione di gas.
Il risultato è un miglioramento drastico della ritenzione della capacità e della stabilità ciclica, aprendo prospettive davvero interessanti per rendere le batterie al sodio una tecnologia matura e competitiva per l’accumulo di energia su larga scala e non solo. Certo, la ricerca continua, ma questo approccio “ibrido” sodio-litio sembra davvero una strada promettente. Stiamo assistendo a una piccola rivoluzione silenziosa nel mondo delle batterie!
Fonte: Springer







