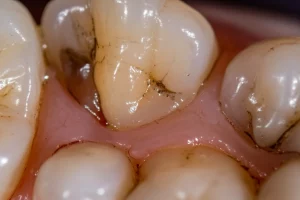
Carie nei Bambini: Svelato il Segreto dell’Espansione Veloce del Batterio “Cattivo”!
Ciao a tutti! Oggi voglio parlarvi di un nemico invisibile ma potentissimo che colpisce i sorrisi dei nostri bambini: la carie della prima infanzia (ECC – Early Childhood Caries). Pensate che quasi la metà dei bimbi in età prescolare in tutto il mondo ne soffre! E la cosa peggiore è che progredisce rapidissimamente, attaccando più dentini contemporaneamente. Un vero incubo per i piccoli e per i genitori.
Ma chi è il colpevole principale di questo disastro? Si chiama Streptococcus mutans (S. mutans), un batterio che, diciamocelo, è una vera superstar nel mondo della carie. Si attacca ai denti, produce acidi che sciolgono lo smalto e crea una specie di “città fortificata” chiamata biofilm, ricca di una sostanza appiccicosa chiamata EPS (Sostanze Polimeriche Extracellulari).
Il Mistero della Diffusione Veloce
Per anni, noi scienziati ci siamo chiesti: ma come fa questo S. mutans, che tra l’altro è un batterio non mobile (cioè non ha “gambe” o “flagelli” per spostarsi attivamente come altri suoi colleghi), a espandersi così velocemente da un dente all’altro? Altri batteri patogeni usano la motilità, il contatto diretto, o si fanno trasportare dai fluidi. Ma S. mutans? Era un bel rompicapo.
Studi recenti su altri batteri (non orali) avevano iniziato a suggerire un ruolo chiave per le forze fisiche generate proprio dalla matrice EPS. Si parlava di pressione osmotica: in pratica, la matrice EPS, ricca di zuccheri complessi (glucani, prodotti soprattutto quando mangiamo saccarosio), attira acqua dall’ambiente circostante, gonfiandosi e “spingendo” verso l’esterno. Poteva essere questa la chiave anche per il nostro S. mutans?
L’Esperimento: Ricreare la “Bocca” in Laboratorio
Per capirci di più, abbiamo deciso di simulare l’ambiente orale, in particolare quello dei bambini piccoli che magari respirano spesso con la bocca o hanno un flusso salivare non ancora ottimale. Abbiamo usato un modello con un’interfaccia aria-solido (usando piastre di agar, una specie di gelatina nutriente) per vedere come si comportava il biofilm di S. mutans in diverse condizioni.
Abbiamo fatto crescere il nostro batterio su agar con:
- Solo glucosio: niente formazione di EPS significativa, nessuna espansione.
- Solo saccarosio: formazione di EPS, ma ancora nessuna espansione vera e propria.
- Saccarosio e alta umidità: l’EPS si formava e sembrava “fluire”, ma niente nuove colonie.
- Saccarosio, alta umidità E polvere di idrossiapatite: BINGO! Qui abbiamo visto il vero spettacolo!
L’idrossiapatite è il minerale principale di cui è fatto lo smalto dei denti (sia quelli da latte che quelli permanenti, anche se quelli da latte ne hanno un po’ meno e sono più vulnerabili). Aggiungerla al nostro modello era fondamentale per simulare la superficie del dente.

La Scoperta: Un Piano in Due Fasi per Conquistare i Denti
E qui viene il bello! Abbiamo scoperto che S. mutans usa una strategia di espansione completamente nuova, in due fasi ben distinte:
Fase 1: L’Onda di EPS Trasportatrice. In presenza di saccarosio e umidità, S. mutans produce abbondante EPS. Questa matrice, grazie alla pressione osmotica (attira acqua dall’agar, proprio come avevamo ipotizzato!), inizia a diffondersi sulla superficie, come un’onda. Ma non si diffonde da sola: trasporta con sé piccoli gruppi di batteri! Immaginate delle zattere di “slime” che portano i batteri in nuove aree. Abbiamo visto proprio questi piccoli “puntini” (cluster batterici) muoversi all’interno dell’EPS che si espandeva.
Fase 2: La Colonizzazione grazie all’Idrossiapatite. Ora, avere i batteri trasportati in una nuova zona non basta per creare una nuova “città” (colonia). Perché? Perché S. mutans, mentre mangia zuccheri, produce acidi. Questi acidi, se si accumulano, rendono l’ambiente troppo ostile per la crescita di nuove colonie batteriche. Ed ecco il ruolo cruciale dell’idrossiapatite (lo smalto)! L’idrossiapatite ha la fantastica proprietà di neutralizzare gli acidi. Reagisce con gli acidi prodotti dai batteri, alzando il pH locale e rendendo l’ambiente di nuovo ospitale. Solo nelle zone dove l’EPS carico di batteri incontrava l’idrossiapatite, abbiamo visto la formazione di nuove, fiorenti colonie batteriche. Senza idrossiapatite, l’EPS si spargeva, ma i batteri trasportati non riuscivano a mettere radici a causa dell’acidità.
Abbiamo analizzato nel dettaglio la crescita di queste nuove colonie (chiamandole R1, R2, R3 a seconda di quando apparivano). Abbiamo notato che le colonie più lontane dalla zona iniziale crescevano più grandi e più velocemente, forse perché avevano meno competizione per le risorse e un ambiente meno acido grazie all’azione continua dell’idrossiapatite.

Perché è Così Importante per la Carie Infantile (ECC)?
Questa scoperta è fondamentale perché spiega finalmente il meccanismo dietro la rapida progressione della carie nei bambini piccoli, che spesso colpisce più denti contemporaneamente.
- La dieta spesso ricca di saccarosio fornisce il carburante perfetto per la produzione di EPS.
- L’ambiente orale dei bambini (magari con respirazione orale o meno saliva) favorisce l’alta umidità che aiuta l’EPS a diffondersi.
- L’EPS trasporta i batteri su nuove superfici dentali (idrossiapatite).
- L’idrossiapatite neutralizza l’acidità iniziale, permettendo ai batteri “pionieri” di stabilirsi e formare nuove colonie cariogene.
È un ciclo vizioso che porta all’espansione rapida della malattia!
Nuove Speranze per la Prevenzione: Mirare all’EPS!
Capire questo meccanismo apre strade importantissime per nuove strategie di prevenzione e trattamento dell’ECC. Se l’EPS è il “veicolo” che trasporta i batteri e la pressione osmotica è il “motore”, allora possiamo pensare di intervenire proprio lì!
Un aspetto super interessante che abbiamo notato è che i batteri trasportati all’interno dell’EPS in espansione sono presenti in quantità relativamente basse (circa 5 milioni di CFU/mL contro i 300 milioni dell’inoculo iniziale). Questo li rende una popolazione vulnerabile! Potrebbe essere una finestra critica per intervenire. Immaginate agenti antimicrobici o anti-biofilm che riescano a penetrare questa matrice EPS meno densa e a colpire i batteri proprio mentre stanno cercando di colonizzare nuove aree.
Quindi, le future strategie potrebbero concentrarsi su:
- Inibire la produzione di EPS o degradarlo con enzimi specifici.
- Bloccare la diffusione dell’EPS, magari alterando le forze osmotiche.
- Colpire i batteri vulnerabili durante la fase di trasporto nell’EPS.
Ovviamente, la nostra ricerca è un primo passo. Il nostro modello era semplificato (una sola specie batterica, niente saliva o altre cellule immunitarie). Future ricerche dovranno considerare l’interazione con altri microbi presenti nella bocca (come la *Candida albicans*, spesso trovata insieme a S. mutans nell’ECC) e l’effetto della saliva.
Ma la strada è tracciata! Aver svelato questo inedito meccanismo di espansione a due fasi dello Streptococcus mutans ci dà una comprensione molto più profonda di come si sviluppa la carie infantile e, soprattutto, ci offre nuovi bersagli concreti per sviluppare strategie preventive e terapeutiche più efficaci. L’obiettivo è proteggere i preziosi sorrisi dei nostri bambini!
Fonte: Springer