Cellule Sotto Pressione: La SUMOilazione, Un’Arma a Doppio Taglio per la Sopravvivenza
Ciao a tutti, appassionati di scienza! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico delle nostre cellule, per scoprire come affrontano situazioni davvero estreme. Immaginate le vostre cellule private improvvisamente di due elementi vitali: ossigeno e glucosio. Una bella gatta da pelare, vero? Questa condizione, che noi scienziati chiamiamo deprivazione di ossigeno e glucosio (OGD), è una sfida seria che può portare le cellule a un bivio: sopravvivere o attivare meccanismi di morte cellulare. Fortunatamente, l’evoluzione ci ha dotato di sistemi sofisticatissimi per “sentire” e rispondere a queste emergenze.
Negli ultimi anni, un meccanismo in particolare sta guadagnando sempre più attenzione: la SUMOilazione. Non spaventatevi per il nome un po’ ostico! Si tratta, in parole povere, dell’aggiunta di una piccola proteina chiamata SUMO (Small Ubiquitin-like Modifier) ad altre proteine bersaglio. Pensatela come una sorta di “etichetta” molecolare che ne modifica la funzione. Ebbene, si è scoperto che un aumento della SUMOilazione in risposta all’OGD può essere un vero e proprio scudo protettivo per le cellule, aprendo nuove, eccitanti prospettive terapeutiche.
Però, c’è un “ma”. Aumentare la SUMOilazione a tappeto, in modo indiscriminato, potrebbe non essere la strategia vincente. Anzi, potrebbe limitare i benefici che un’azione più mirata su specifici bersagli proteici potrebbe offrire. È un po’ come dare un farmaco generico quando servirebbe una terapia personalizzata. Per far luce su questo aspetto, abbiamo intrapreso uno studio approfondito, utilizzando un approccio proteomico su cellule P19, per identificare quali proteine vengono specificamente “etichettate” con SUMO2/3 (una delle forme di SUMO più coinvolte nella risposta allo stress) durante l’OGD e per capire che ruolo gioca questa modificazione nella loro capacità di proteggere le cellule dalla morte.
Caccia ai Bersagli: Chi Viene SUMOilato Sotto Stress?
Cosa abbiamo scoperto? Beh, preparatevi, perché i risultati sono davvero interessanti! Le proteine che vengono SUMOilate in risposta all’OGD sono per lo più coinvolte nella trascrizione (il processo di lettura del DNA per produrre proteine) e nel processamento dell’RNA. È come se la cellula, sotto stress, decidesse di “mettere mano” proprio alla sua centrale di comando genetico. Un altro dato cruciale è la dinamicità di questa modifica: la maggior parte di queste proteine viene rapidamente de-SUMOilata (cioè, perde l’etichetta SUMO) non appena ossigeno e glucosio tornano disponibili (condizione che chiamiamo ROG, Restoring Oxygen and Glucose). Questo conferma che la SUMOilazione è un processo estremamente reattivo e finemente regolato.
Dato che l’OGD è strettamente legata a condizioni patologiche come l’ischemia cerebrale, abbiamo voluto vedere se ci fossero differenze significative tra cellule in proliferazione e cellule differenziate in neuroni. Sorprendentemente, non abbiamo osservato grandi stravolgimenti nel “SUMO-proteoma” (l’insieme delle proteine SUMOilate) tra i due tipi cellulari. Sembra che i meccanismi di base siano conservati.
Non Tutta la SUMOilazione Vien per Nuocere (o per Proteggere)
Qui la faccenda si fa ancora più intrigante. Abbiamo dimostrato che la sovraespressione di alcuni attori chiave, come il fattore di trascrizione SOX2 o la ligasi SUMO PIAS4 (un enzima che aiuta ad attaccare SUMO alle proteine), ha un chiaro effetto protettivo sulle cellule, e questo effetto dipende in gran parte dalla loro capacità di essere SUMOilate. Anche mantenere la capacità di SUMOilazione del coregolatore NAB2 si è rivelato importante per affrontare l’OGD.
Tuttavia, non è sempre così. Prendiamo ad esempio il fattore di pluripotenza OCT4. Anche lui viene SUMOilato sotto OGD, ma in questo caso la SUMOilazione sembra bloccare la sua capacità di promuovere la sopravvivenza cellulare! Abbiamo anche identificato il “killer” di questa SUMOilazione: una proteasi SUMO chiamata SENP7, che rimuove l’etichetta SUMO da OCT4 quando le condizioni tornano normali. Questo ci suggerisce che, per ottenere la massima protezione cellulare, potrebbe essere necessario un cocktail ben bilanciato di forme SUMOilate e non SUMOilate di specifici fattori.
Come Funziona la SUMOilazione? Un Breve Ripasso
Per chi non fosse addentro ai meccanismi molecolari, la SUMOilazione è un processo a più fasi. Dopo una “maturazione” da parte di specifiche proteasi SUMO, la molecola SUMO viene attivata da un enzima E1 (SAE1/UBA2), trasferita a un enzima coniugante E2 (UBC9), che infine, spesso con l’aiuto di una ligasi E3 (come le PIAS), attacca SUMO a un residuo di Lisina (K) sulla proteina bersaglio. Le proteasi SUMO, come le SENP, non solo maturano SUMO ma lo riciclano anche, staccandolo dai bersagli. È un equilibrio dinamico, essenziale per la vita e, come stiamo vedendo, cruciale nella risposta allo stress.
È interessante notare che SUMO2/3, a differenza di SUMO1, è abbondante nella cellula in forma libera e viene rapidamente attaccato alle proteine in risposta a vari stimoli di stress, inclusa l’ischemia. SUMO2/3 può anche formare catene poli-SUMO, amplificando il segnale.
I Dettagli del Nostro Studio: Un’Analisi Cinetica e Proteomica
Per il nostro studio, abbiamo scelto le cellule P19 di carcinoma embrionale di topo, che hanno la fantastica caratteristica di essere pluripotenti e facilmente differenziabili. Per prima cosa, abbiamo determinato i tempi giusti: abbiamo visto che il picco di SUMOilazione si raggiungeva dopo 2.5 ore di OGD, e che 2.5 ore di ROG erano sufficienti per tornare ai livelli normali. Come controllo, abbiamo monitorato i livelli del fattore di ipossia HIF1α, un classico marcatore della deprivazione di ossigeno.
Per “pescare” le proteine SUMOilate, abbiamo creato linee cellulari stabili che esprimevano una versione di SUMO2 con un’etichetta speciale (His10-SUMO2). Questo ci ha permesso di purificare selettivamente le proteine modificate con His10-SUMO2 usando biglie di Ni-NTA e poi analizzarle con la spettrometria di massa. I risultati sono stati solidi e riproducibili.
Nelle cellule in proliferazione, abbiamo identificato 670 proteine, di cui 434 potevano essere considerate substrati della SUMOilazione. Confrontando OGD e condizioni normali, 136 proteine aumentavano la loro SUMOilazione e 43 la diminuivano. La stragrande maggioranza (87%) di quelle che aumentavano la SUMOilazione sotto OGD, la perdevano poi con ROG, confermando l’alta dinamicità del processo.

L’analisi di “Gene Ontology” (GO), che raggruppa le proteine per funzione, ha rivelato che quelle con aumentata SUMOilazione sotto OGD erano principalmente legate, come detto, alla trascrizione e al processamento dell’RNA, ma anche all’organizzazione della cromatina e, curiosamente, alla SUMOilazione stessa. Quelle che invece diminuivano la loro SUMOilazione erano coinvolte nella regolazione del ciclo cellulare, nel differenziamento/mantenimento della staminalità e nella riparazione del DNA.
Cellule Differenziate: Stessi Attori, Stesso Copione?
Passando alle cellule differenziate in neuroni (usando acido retinoico), abbiamo identificato un numero minore di proteine con SUMOilazione alterata (56 in aumento sotto OGD). Tuttavia, la maggior parte di queste (80%) erano le stesse identificate nelle cellule proliferanti! Anche le categorie funzionali GO erano simili, con un arricchimento per proteine coinvolte nello sviluppo del cervello anteriore, a conferma dell’efficacia del differenziamento. Questo suggerisce che i bersagli di SUMO2 in risposta all’OGD sono probabilmente fattori generali che regolano aspetti cellulari comuni come metabolismo, crescita e divisione, piuttosto che processi specifici del tipo cellulare.
Validazione e Focus su Protagonisti Chiave
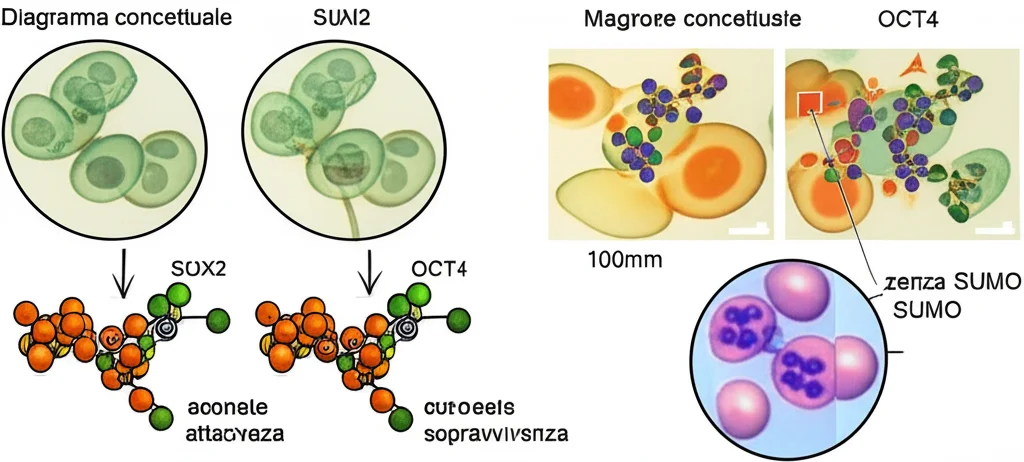
Abbiamo poi validato i nostri risultati di proteomica concentrandoci su alcuni “pezzi da novanta” legati alla trascrizione: i fattori OCT4 e SOX2, e i coregolatori NAB2, HMG20B, NCOR1 e la ligasi PIAS4.
- OCT4 SUMOilato appariva in modo massiccio sotto OGD, con bande multiple indicative di modificazione da parte di più molecole SUMO2 (probabilmente catene poli-SUMO2).
- SOX2 SUMOilato appariva anch’esso solo con OGD, ma come una singola banda.
- NAB2 SUMOilato, presente sotto OGD, mostrava diverse bande, dovute a due siti di SUMOilazione indipendenti che avevamo già identificato in passato.
- PIAS4 mostrava un aumento di SUMOilazione sotto OGD, ma una certa quota era SUMOilata anche in condizioni normali.
- HMG20B era SUMOilato in tutte le condizioni, ma l’OGD ne aumentava i livelli modificati.
- NCOR1 SUMOilato era rilevabile esclusivamente sotto OGD.
Come accennato, OCT4 sotto OGD forma diverse bande più pesanti, suggerendo catene poli-SUMO2. Dato che la proteasi SENP7 è specializzata nel “tagliare” queste catene e noi avevamo precedentemente visto che SENP7 viene indotta da ROG dopo essere stata ridotta sotto OGD, ci siamo chiesti: OCT4 SUMOilato è un bersaglio di SENP7? La risposta è sì! Sovraesprimendo SENP7 durante l’OGD, le forme SUMOilate di OCT4 sparivano. Viceversa, silenziando SENP7, la de-SUMOilazione di OCT4 durante ROG veniva impedita. Quindi, OCT4 SUMOilato è un cliente fisso di SENP7 quando le condizioni migliorano.
L’Impatto sulla Sopravvivenza: Un Gioco di Equilibri Fini
Ma la domanda da un milione di dollari è: come impatta la SUMOilazione di questi specifici fattori sulla capacità delle cellule di sopravvivere a un OGD prolungato e dannoso (20 ore)? Per scoprirlo, abbiamo sovraespresso le versioni normali (WT) o mutanti non SUMOilabili (KR) di OCT4, SOX2, NAB2 e PIAS4.
- OCT4: Sorprendentemente, sovraesprimere la versione mutante KR (non SUMOilabile) riduceva la tossicità dell’OGD, mentre la versione WT non aveva effetto. Questo suggerisce che la SUMOilazione di OCT4 è controproducente per la sopravvivenza.
- SOX2: Al contrario, la sovraespressione di SOX2 WT riduceva drasticamente la tossicità, mentre il mutante KR aveva un effetto minore, seppur positivo. Qui, la SUMOilazione sembra benefica.
- NAB2: La versione WT non aveva effetti, ma il mutante KR aumentava la citotossicità! Ciò indica che la capacità di NAB2 di essere SUMOilato è necessaria per la protezione cellulare.
- PIAS4: Comportamento simile a SOX2. La versione WT riduceva la tossicità, mentre il mutante KR non aveva impatto. Anche qui, la SUMOilazione di PIAS4 è protettiva.
Questi risultati sono potentissimi! Ci dicono che non basta aumentare la SUMOilazione a caso. Ogni proteina fa storia a sé. Per alcune, come SOX2 e PIAS4, essere SUMOilate è un vantaggio. Per altre, come OCT4, è uno svantaggio. Per NAB2, è cruciale mantenere la *capacità* di essere SUMOilato.
Implicazioni Terapeutiche: Verso una SUMOilazione “Intelligente”
Cosa significa tutto questo in prospettiva? Significa che, sebbene un aumento globale della SUMOilazione possa avere un effetto protettivo generale, per esempio nell’ischemia, potremmo ottenere risultati molto migliori agendo in modo selettivo. Immaginate terapie che promuovano la SUMOilazione di PIAS4, NAB2 e SOX2, ma che al contempo favoriscano la de-SUMOilazione di OCT4. Questo potrebbe essere possibile modulando l’attività di specifiche ligasi e proteasi SUMO con farmaci mirati.
Si è già visto che trapiantare cellule staminali neurali con SUMOilazione potenziata (grazie alla sovraespressione di UBC9) in modelli di ictus ischemico ne aumenta la sopravvivenza e il differenziamento. Allo stesso modo, cellule che sovraesprimono PIAS4 WT, NAB2 WT, SOX2 WT, ma un OCT4 mutante non SUMOilabile, potrebbero avere tassi di sopravvivenza ancora più alti e quindi un grande potenziale terapeutico per l’ischemia.
È affascinante pensare che non sia solo l’aumento della SUMOilazione sotto stress a proteggere, ma anche la successiva, precisa de-SUMOilazione da parte di specifiche proteasi SENP quando le condizioni migliorano. Queste proteasi sembrano avere un ruolo nel “misurare” la profondità del danno e nel contribuire alla decisione finale tra sopravvivenza e morte. Le proteasi SENP1 e SENP3, ad esempio, vengono inattivate rapidamente e reversibilmente dall’ipossia, mentre noi abbiamo visto che SENP7 viene temporaneamente ridotta durante l’OGD.
Insomma, il mondo della SUMOilazione è un universo complesso e dinamico, pieno di attori che giocano ruoli specifici e talvolta opposti. Capire a fondo queste dinamiche è fondamentale per poter sfruttare appieno il potenziale terapeutico di questo affascinante meccanismo di modifica proteica. La strada è ancora lunga, ma le scoperte che stiamo facendo aprono scenari davvero promettenti per affrontare condizioni mediche gravi come l’ischemia. E io, da ricercatore, non potrei essere più entusiasta di continuare a esplorare questi sentieri!
Fonte: Springer