Intestino in Provetta: Come Stiamo Ricreando il Nostro Secondo Cervello in Laboratorio!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo della biotecnologia, un campo dove cerchiamo di imitare la natura per capirla meglio e, magari, per trovare nuove cure. Avete mai pensato a quanto sia incredibilmente complesso il nostro intestino? Non è solo un tubo per digerire il cibo; è un ecosistema vibrante, pieno di cellule specializzate e microrganismi amici, fondamentale per la nostra salute. Ma studiarlo non è affatto semplice. I metodi tradizionali, come le colture cellulari piatte (in 2D, tipo su una piastra di Petri), sono un po’ come cercare di capire una foresta guardando una singola foglia: mancano troppi dettagli!
Il Problema: Modelli Vecchi, Sfide Nuove
Per anni, noi ricercatori ci siamo scontrati con i limiti delle colture 2D. Non riescono a replicare l’architettura tridimensionale pazzesca dell’intestino, quella fatta di villi (le “dita” che assorbono i nutrienti) e cripte (le “valli” dove nascono nuove cellule). Senza questa struttura, le cellule non si comportano come farebbero nel nostro corpo, non si differenziano bene e non interagiscono correttamente tra loro o con i microbi.
Certo, sono stati fatti passi da gigante con gli organoidi – mini-organi cresciuti in laboratorio da cellule staminali. Sono fantastici, ma richiedono tempi lunghissimi (settimane!) per svilupparsi e manipolarli, ad esempio per studiare infezioni, è complicato. Anche tecniche avanzate come la stampa 3D o la microfabbricazione hanno aiutato a creare strutture più realistiche, ma spesso sono processi complessi, costosi e difficili da usare su larga scala. Insomma, serviva qualcosa di più… qualcosa di ispirato direttamente dalla natura, ma più semplice e veloce.
La Nostra Idea: Copiare la Natura con un Trucco Geniale
Ed è qui che entra in gioco la nostra idea! Ci siamo chiesti: e se potessimo creare una superficie che imita già la forma dei villi e delle cripte, in modo che le cellule si sentano subito “a casa”? Abbiamo trovato un modo sorprendentemente semplice, senza bisogno di laboratori super-attrezzati (le famose “cleanroom”) o tecniche complicate.
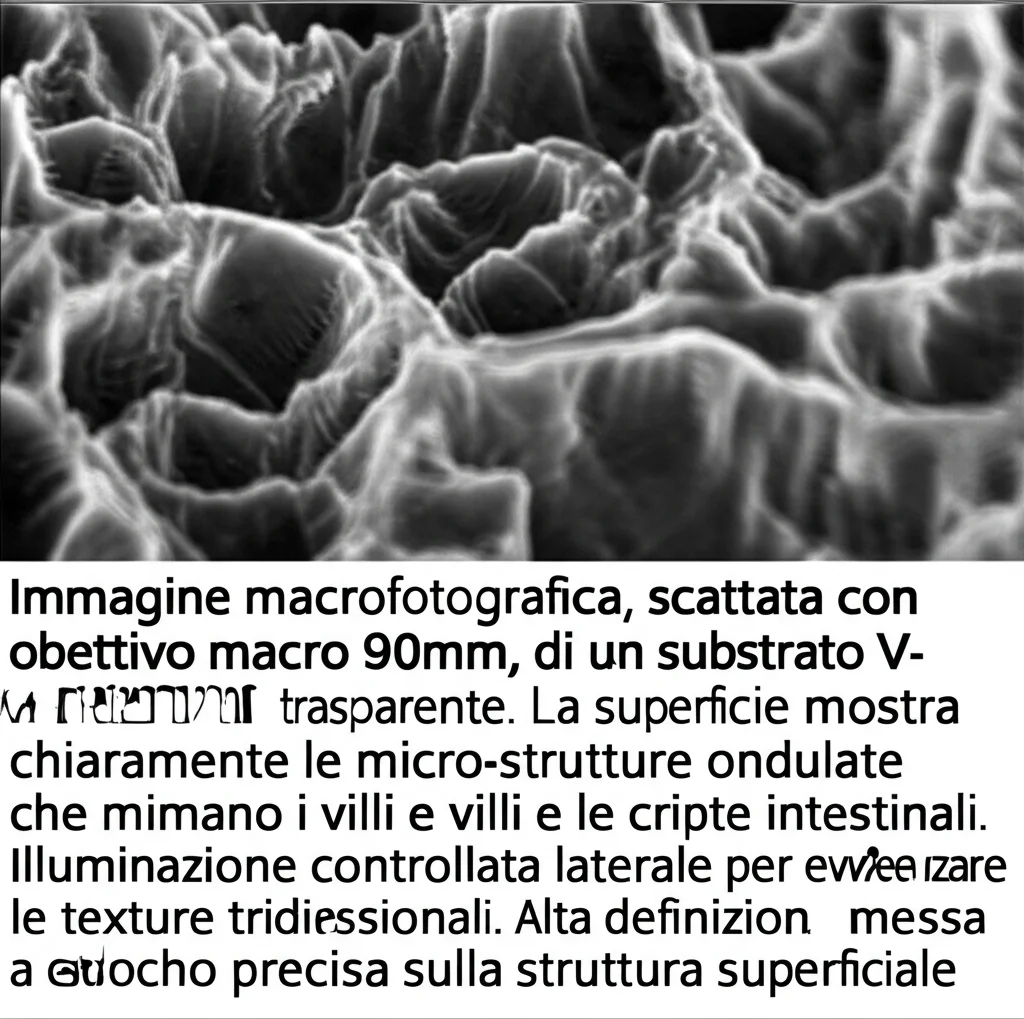
Usiamo dei film di polistirene (un tipo di plastica) che, quando vengono scaldati, si restringono creando delle micro-rughe in modo spontaneo. È un po’ come quando un foglio di plastica si accartoccia vicino a una fonte di calore. Controllando bene temperatura e tipo di film, otteniamo una superficie con picchi e valli delle dimensioni giuste, proprio come quelle dell’intestino!
Poi, usiamo questa superficie “rugosa” come stampo. Ci versiamo sopra del PDMS (un silicone biocompatibile, tipo quello usato per le lenti a contatto morbide) e, una volta solidificato, otteniamo una replica perfetta, ma in negativo, della struttura. Questo substrato in PDMS, però, è idrofobo (respinge l’acqua) e le cellule non ci si attaccano volentieri. Quindi, lo trattiamo chimicamente e lo rivestiamo con una matrice extracellulare (ECM) – una miscela di proteine naturali che nel nostro corpo fa da “impalcatura” e da segnale per le cellule. Il risultato? Un substrato che abbiamo chiamato V-ECM: “V” sta per villi-cripte e “ECM” per il rivestimento. È flessibile, trasparente e, soprattutto, ha la forma giusta e la superficie giusta per accogliere le cellule intestinali.
Cellule Felici: Crescita Rapida e Differenziazione Record
Abbiamo provato a coltivare su questi substrati V-ECM una miscela di due tipi di cellule umane molto usate per simulare l’intestino: le Caco-2 (che mimano gli enterociti, le cellule assorbenti) e le HT29-MTX-E12 (che mimano le cellule caliciformi, quelle che producono muco). I risultati sono stati sbalorditivi!
In soli 3-5 giorni (72-120 ore), le cellule non solo hanno coperto tutta la superficie, ma hanno iniziato a organizzarsi spontaneamente seguendo la forma dei nostri micro-villi e micro-cripte. Hanno formato uno strato epiteliale compatto, con cellule alte e polarizzate (cioè con una parte “sopra” e una “sotto” ben distinte), proprio come nell’intestino vero. Sui substrati piatti di controllo (F-ECM, cioè piatti ma con ECM), le cellule crescevano, sì, ma in modo più disordinato, formando qualche villo qua e là, ma molto più fragili e meno organizzati.
Abbiamo misurato la barriera epiteliale usando una tecnica chiamata TEER (Trans-Epithelial Electrical Resistance), che misura quanto è “impermeabile” lo strato di cellule. I valori sui nostri V-ECM erano alti e stabili, segno di una barriera forte e ben formata, molto più velocemente rispetto ai metodi tradizionali. E la cosa più bella? Queste strutture erano stabili! Non si staccavano facilmente come quelle cresciute sui substrati piatti.
Un Intestino Funzionante in Miniatura
Ma l’aspetto non è tutto. Volevamo sapere se queste cellule si comportassero anche come un vero epitelio intestinale. Abbiamo analizzato l’espressione genica e la presenza di proteine specifiche. Sui V-ECM, abbiamo visto che:
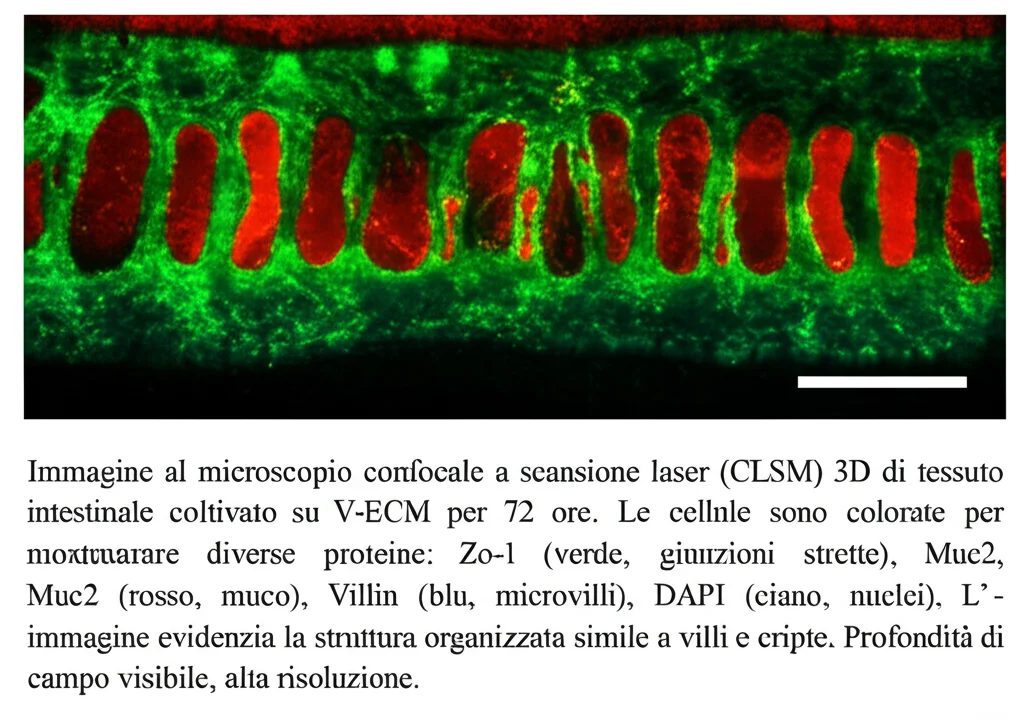
- Le cellule esprimevano correttamente le proteine delle giunzioni strette (come la Zo-1), essenziali per sigillare la barriera.
- Le cellule produttrici di muco (marcate con Muc2) si localizzavano nelle zone giuste, producendo molto più muco (visibile con la colorazione Alcian Blue) rispetto ai controlli.
- Le cellule assorbenti esprimevano Villin, una proteina tipica dei microvilli sulla loro superficie apicale.
- Le cellule in attiva proliferazione (marcate con Ki-67) e quelle con caratteristiche “staminali” (marcate con Sox9) si trovavano principalmente nelle zone simili alle cripte, proprio come succede in vivo!
Questo significa che il nostro substrato V-ECM non solo accelera la crescita, ma guida anche le cellule a differenziarsi e a organizzarsi spazialmente in modo incredibilmente simile all’intestino naturale. È come se la forma del substrato “dicesse” alle cellule dove andare e cosa diventare!
Abbiamo anche testato le funzioni digestive. Le cellule sui V-ECM mostravano un’attività molto più alta di enzimi chiave come la sucrase (che digerisce lo zucchero) e la fosfatasi alcalina (ALPase). Inoltre, erano bravissime ad assorbire acidi grassi fluorescenti che gli fornivamo nel mezzo di coltura e a trasformarli in trigliceridi (grassi di riserva), proprio come fanno gli enterociti veri. Sui controlli piatti, queste funzioni erano molto ridotte o limitate solo ai pochi villi auto-formati.
La Prova del Fuoco: Resistere alle Infezioni
L’intestino è la nostra prima linea di difesa contro i patogeni ingeriti. Come si sarebbero comportati i nostri tessuti V-ECM di fronte a un’infezione batterica? Abbiamo aggiunto Escherichia coli (un batterio comune, a volte patogeno) alle colture.
Sui substrati piatti di controllo, è stato un disastro: i batteri hanno rapidamente colonizzato la superficie, distrutto lo strato cellulare e formato biofilm spessi. Invece, sui V-ECM, è successa una cosa incredibile. I batteri facevano molta più fatica ad attaccarsi stabilmente. Perché? Grazie allo strato di muco protettivo e scivoloso prodotto dalle cellule differenziate! Inoltre, le cellule sui V-ECM, sentendosi minacciate, hanno iniziato a produrre molti più peptidi antimicrobici naturali (come la beta-defensina 2, HBD2), delle vere e proprie “armi” molecolari contro i batteri.
Il risultato? Dopo 72 ore di co-cultura con E. coli, i tessuti su V-ECM erano ancora quasi intatti, con pochi batteri adesi e pochissimi invasivi, mentre i controlli erano devastati. La barriera TEER sui V-ECM è rimasta alta, anzi è persino aumentata (forse per via del muco extra e dei batteri intrappolati sopra?), mentre sui controlli è crollata. Questo dimostra che il nostro modello non solo imita la struttura e la funzione, ma anche la capacità di difesa dell’intestino!
Un Campo di Battaglia per Testare Nuove Armi: La Terapia Fagica
Questa resistenza alle infezioni ci ha dato un’altra idea: usare i nostri V-ECM come piattaforma per testare nuove terapie, specialmente contro i batteri resistenti agli antibiotici, una minaccia globale crescente. Abbiamo infettato i tessuti V-ECM con un ceppo di E. coli resistente alla Kanamicina (un comune antibiotico). Come previsto, trattare l’infezione con Kanamicina non ha avuto alcun effetto: i batteri hanno continuato a proliferare.
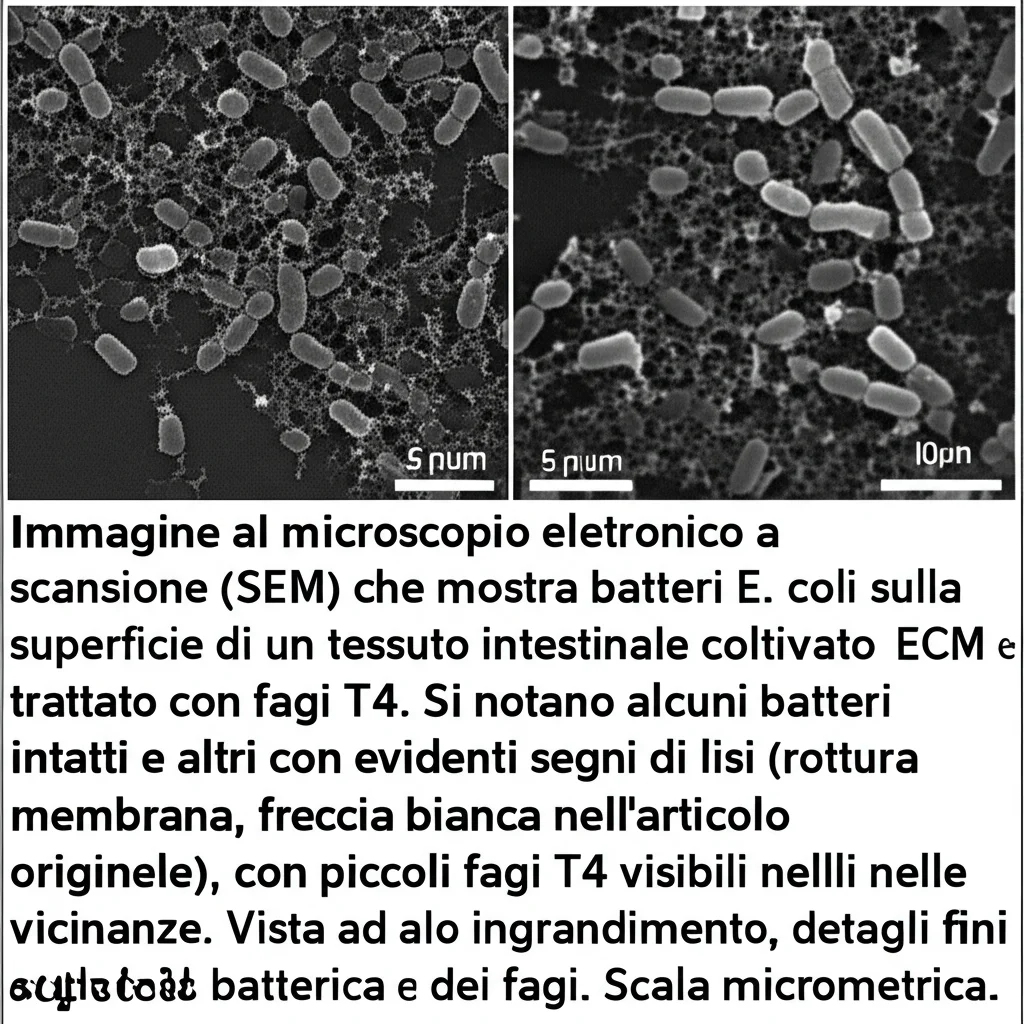
Allora abbiamo provato un’alternativa: la terapia fagica. I batteriofagi (o fagi) sono virus che infettano specificamente i batteri, li usano per replicarsi e poi li fanno scoppiare (lisi), rilasciando nuovi fagi pronti a infettare altri batteri. È una sorta di “nemico naturale” dei batteri. Abbiamo aggiunto fagi T4 (specifici per E. coli) alla coltura infetta.
I risultati sono stati spettacolari! In sole 24 ore, i fagi hanno decimato la popolazione di E. coli resistente. Abbiamo visto al microscopio elettronico i batteri “bucati” e distrutti dai fagi. Mentre l’antibiotico era inutile, i fagi si sono dimostrati un’arma efficacissima. Questo esperimento dimostra che i nostri V-ECM possono essere uno strumento prezioso per testare rapidamente l’efficacia di nuove strategie terapeutiche come la terapia fagica.
Verso Modelli Ancora Più Complessi: l’Intestino-su-Chip
Per rendere il nostro modello ancora più realistico, abbiamo integrato i substrati V-ECM in sistemi microfluidici, i cosiddetti “Organ-on-a-Chip” (OoC). Questi dispositivi permettono di far fluire il mezzo di coltura sopra le cellule, simulando il movimento del contenuto intestinale e applicando uno stress da scorrimento (shear stress), un altro stimolo importante per la differenziazione delle cellule intestinali.
Abbiamo usato un sistema a “dondolo” programmabile per creare un flusso pulsatile. Abbiamo visto che, con il flusso, le cellule sui V-ECM si differenziavano ancora meglio, producevano più muco e formavano una barriera ancora più forte rispetto alle colture statiche (senza flusso). Inoltre, la struttura V-ECM proteggeva le cellule dal distacco causato dal flusso, cosa che invece avveniva sui substrati piatti.
Abbiamo anche creato chip a due canali separati da una membrana V-ECM porosa (P.V-ECM), permettendo di coltivare le cellule intestinali sopra e cellule dei vasi sanguigni (HUVEC) sotto. Questo apre la porta a studi sull’assorbimento dei nutrienti (o dei farmaci) e sulla comunicazione tra intestino e sistema circolatorio, mimando ancora più fedelmente la complessità del nostro corpo.
Il Futuro è Qui: Coltivare Cellule Primarie Umane
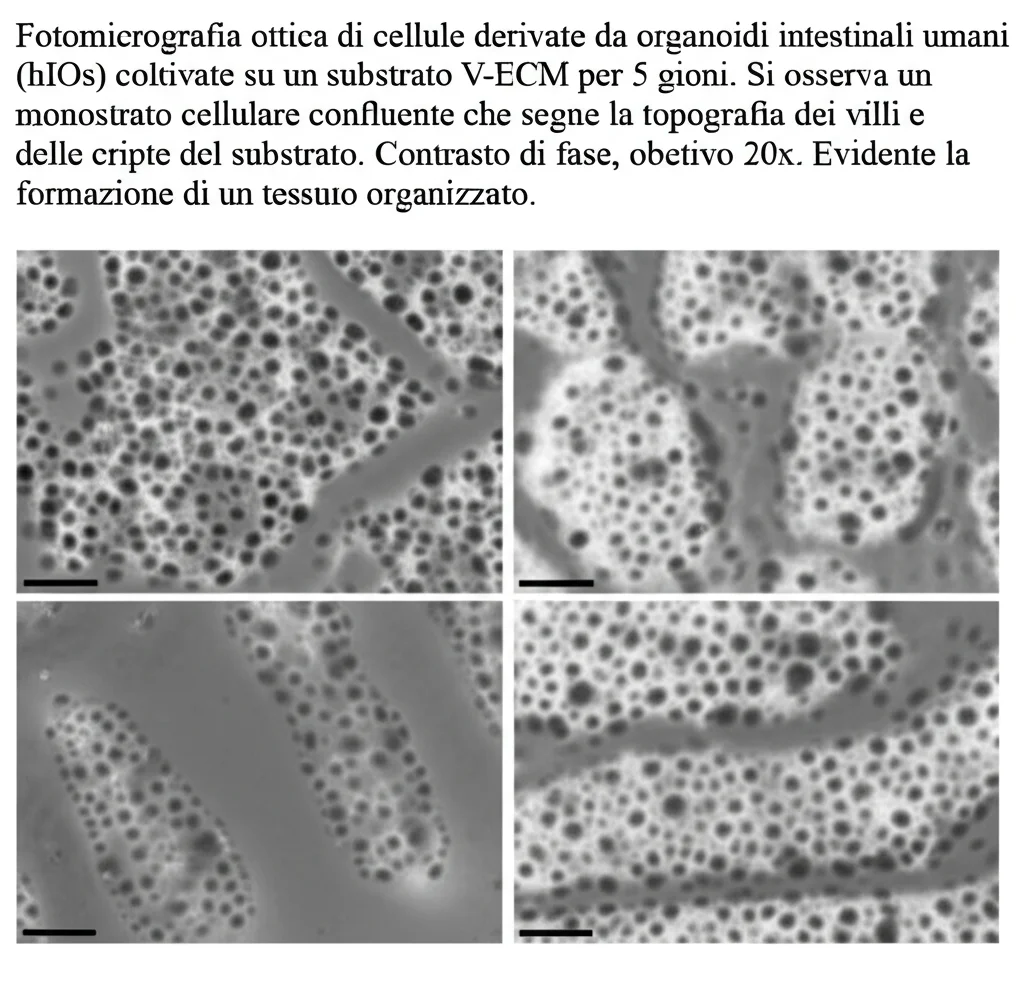
Finora abbiamo parlato di linee cellulari, che sono comode ma pur sempre derivate da tumori o immortalizzate. Il vero salto di qualità è poter usare cellule primarie, prelevate direttamente da pazienti. Abbiamo provato a coltivare sui nostri V-ECM cellule derivate da organoidi intestinali umani (hIOs) ottenuti da biopsie duodenali.
Anche qui, i risultati sono stati entusiasmanti. Le cellule primarie hanno aderito, proliferato e si sono differenziate magnificamente sui V-ECM in circa 5 giorni, formando un epitelio funzionale che esprimeva marcatori di differenziazione (come enzimi digestivi, trasportatori, muco) a livelli simili a quelli degli organoidi “maturi” di partenza (hIO-D), ma molto superiori a quelli degli organoidi semplicemente espansi (hIO-exp) o delle colture piatte su Matrigel. E, cosa fondamentale, la struttura V-ECM permette un accesso diretto alla parte apicale (luminale) delle cellule, cosa difficilissima negli organoidi tradizionali che hanno una struttura chiusa “apicale-interna”. Questo è un vantaggio enorme per testare farmaci o studiare interazioni con il lume intestinale.
Cosa Significa Tutto Questo?
Abbiamo sviluppato una piattaforma biomimetica, relativamente semplice ed economica da produrre, che permette di coltivare cellule intestinali (sia linee cellulari che primarie) facendole differenziare e organizzare in modo molto simile all’intestino umano, e in tempi rapidissimi (giorni invece di settimane). Questi “mini-intestini” su V-ECM non solo hanno la struttura giusta, ma funzionano: digeriscono, assorbono, producono muco e si difendono dalle infezioni.
Le applicazioni sono enormi:
- Studiare le malattie intestinali: Comprendere meglio condizioni come il morbo di Crohn, la colite ulcerosa, le infezioni o la sindrome dell’intestino irritabile.
- Testare farmaci: Valutare l’efficacia e la tossicità di nuovi farmaci in modo più predittivo rispetto ai modelli attuali, riducendo forse la necessità di test su animali.
- Microbiota: Studiare l’interazione complessa tra le nostre cellule e i miliardi di microbi che ospitiamo.
- Nutrizione: Capire come vengono assorbiti i nutrienti e come la dieta influisce sulla salute intestinale.
- Medicina personalizzata: In futuro, potremmo usare cellule di un paziente specifico per creare un modello del suo intestino e testare terapie su misura.
È un passo avanti entusiasmante nel tentativo di ricreare la complessità della biologia umana in laboratorio. C’è ancora tanta strada da fare, ma strumenti come i nostri substrati V-ECM ci avvicinano a comprendere meglio – e magari a curare meglio – quel meraviglioso e complesso organo che è il nostro intestino. Spero che questo viaggio vi abbia appassionato quanto appassiona noi farlo ogni giorno in laboratorio!
Fonte: Springer