Viaggio al Centro della Cellula: Svelati i Segreti dei Trasportatori di Riboflavina!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo delle nostre cellule, per scoprire come una vitamina essenziale, la riboflavina (meglio conosciuta come Vitamina B2), riesca a entrare e a svolgere il suo importantissimo lavoro. Sembra semplice, vero? Prendiamo un integratore o mangiamo cibi che la contengono, e il gioco è fatto. Ma vi siete mai chiesti come fa esattamente la riboflavina a superare la “dogana” della membrana cellulare? È qui che entrano in gioco dei protagonisti incredibili: i trasportatori di riboflavina umani, o RFVT.
L’Importanza Cruciale della Riboflavina (e dei suoi Portieri)
Prima di tuffarci nei dettagli tecnici, capiamo perché la riboflavina è così fondamentale. È il precursore di due molecole potentissime, il flavin mononucleotide (FMN) e il flavin adenina dinucleotide (FAD). Questi nomi forse non vi dicono molto, ma FMN e FAD sono cofattori chiave per tantissimi enzimi nel nostro corpo. In pratica, sono come delle piccole “chiavi inglesi” che permettono a molti processi metabolici di funzionare correttamente, dalla produzione di energia alla sintesi di molecole complesse.
Il problema? Noi umani non siamo capaci di produrre riboflavina da soli. Dobbiamo assumerla con la dieta (l’Autorità Europea per la Sicurezza Alimentare ne raccomanda almeno 1 mg al giorno per gli adulti). Ma una volta ingerita, come arriva dove serve? Ecco i nostri eroi: RFVT1, RFVT2 e RFVT3. Sono proteine specializzate, codificate dai geni *SLC52A1-3*, che si occupano di assorbire, distribuire e riassorbire la riboflavina. Ognuno ha una sua “zona” preferita: RFVT1 si trova principalmente nella placenta e nell’intestino tenue, RFVT3 abbonda nei testicoli, intestino, reni e placenta, mentre RFVT2 è un po’ ovunque, ma specialmente nel cervello.
Capite bene che se questi trasportatori non funzionano a dovere, sono guai seri. Mutazioni nei geni RFVT possono causare malattie metaboliche gravi come la deficienza multipla di acil-CoA deidrogenasi (MADD) o la rara sindrome di Brown-Vialetto-van Laere. Non solo: sembra che questi trasportatori siano sovraespressi in alcuni tipi di tumore, il che apre scenari interessanti per future terapie antitumorali mirate.
La Sfida: Vedere l’Invisibile
Nonostante la loro importanza, capire esattamente come funzionano gli RFVT a livello molecolare è stata una vera sfida. Sono proteine di membrana relativamente piccole (circa 50 kDa), senza grandi “maniglie” esterne a cui aggrapparsi per studiarle. Come fare a “fotografarle” in azione? Qui entra in gioco la tecnologia avanzata. Nel nostro studio, abbiamo utilizzato la crio-microscopia elettronica (cryo-EM), una tecnica potentissima che permette di visualizzare le molecole a risoluzioni incredibili.
Per superare il problema delle dimensioni ridotte, abbiamo usato un piccolo trucco: abbiamo “etichettato” i nostri RFVT (specificamente RFVT2 e RFVT3) legandoli a una proteina fluorescente (GFP) e a un “nanobody”, una sorta di mini-anticorpo che riconosce la GFP. Questa “zavorra” ci ha aiutato ad allineare le particelle nel microscopio, senza però interferire troppo con la funzione dei trasportatori (abbiamo verificato che mantenessero le loro caratteristiche chiave!).
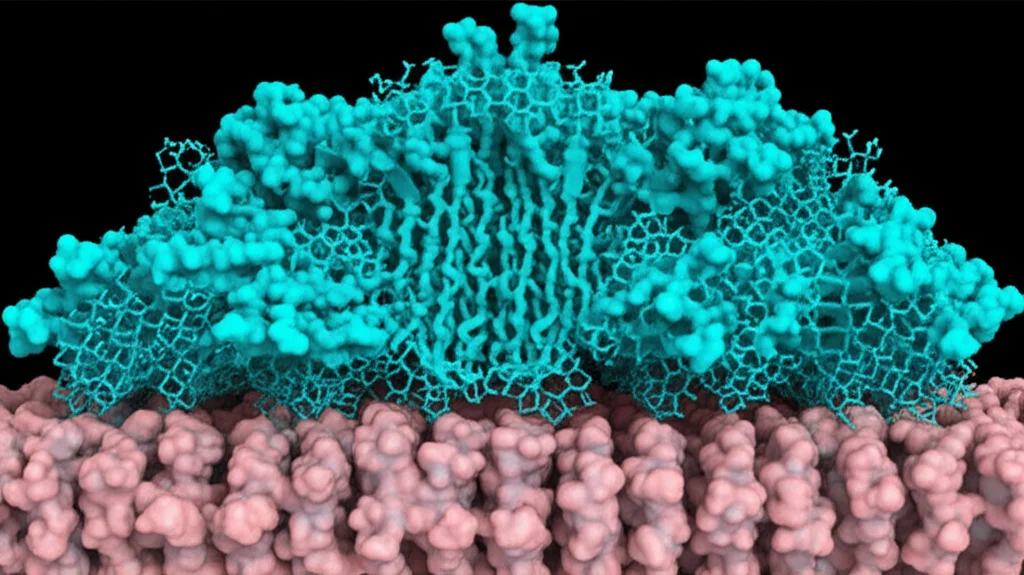
Due Istantanee Cruciali: RFVT2 e RFVT3 in Azione
Grazie a questo approccio, siamo riusciti a ottenere le strutture tridimensionali di RFVT2 e RFVT3 “colti sul fatto”, mentre legano una molecola di riboflavina. Ed ecco la sorpresa: li abbiamo trovati in due stati conformazionali diversi, due “istantanee” di momenti chiave del loro ciclo di trasporto!
* RFVT2 è stato catturato in uno stato “occluso verso l’esterno”: immaginate una porta girevole che ha appena fatto entrare qualcuno dall’esterno ma non si è ancora aperta completamente verso l’interno. La riboflavina è lì, nella cavità centrale, ma parzialmente bloccata dall’esterno.
* RFVT3, invece, era in uno stato “aperto verso l’interno”: la porta girevole si è aperta verso il citosol, pronta a rilasciare il suo prezioso carico all’interno della cellula.
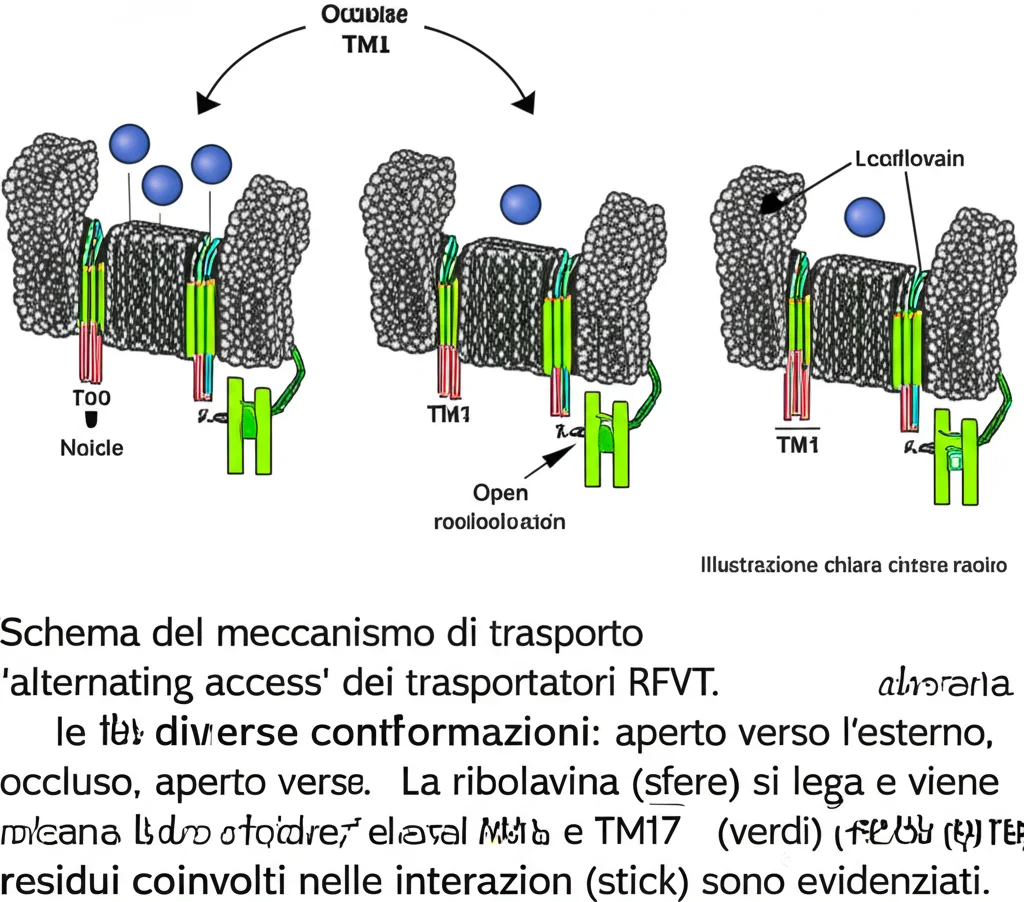
Queste due strutture rappresentano due momenti fondamentali del meccanismo di trasporto, che assomiglia molto a quello di altre famiglie di trasportatori (come la Major Facilitator Superfamily, MFS), anche se gli RFVT hanno delle peculiarità uniche. Entrambi sono formati da 11 eliche che attraversano la membrana (TM1-11), organizzate in due domini (N-terminale con TM1-6 e C-terminale con TM7-11). È affascinante vedere come questi due domini si muovano l’uno rispetto all’altro, un po’ come una sedia a dondolo (“rocker-switch”), per permettere il passaggio della riboflavina.
Come Riconoscono la Riboflavina? La Tasca Segreta
Ma come fanno a riconoscere specificamente la riboflavina e non altre molecole? Abbiamo scoperto una “tasca” di legame molto conservata, situata nella cavità centrale formata dalle eliche TM1, TM4, TM5, TM7, TM10 e TM11. La riboflavina si posiziona verticalmente in questa tasca, stabilendo una fitta rete di interazioni con i residui aminoacidici circostanti.
In RFVT2, ad esempio, la parte piatta della riboflavina (l’anello isoallossazinico) è come “stretta in un sandwich” tra due residui di triptofano (W24 e W31) e un’asparagina (N291). Abbiamo fatto esperimenti mutando questi residui e abbiamo visto che W24 e N291 sono assolutamente critici, mentre W31 sembra agire come un “coperchio”. Anche la “coda” idrofila della riboflavina (il ribitile) forma legami importanti. È interessante notare che questa tasca spiega perché FMN e FAD, pur potendo inibire il trasporto, non vengono trasportati efficientemente: lo spazio vicino alla coda sembra troppo piccolo per ospitare i loro gruppi aggiuntivi (fosfato e adenina).
Una scoperta inaspettata in RFVT2 è stata la possibile presenza di una seconda molecola di riboflavina, legata più esternamente, in un vestibolo. Non siamo sicuri del suo ruolo: potrebbe essere un sito di “attracco” temporaneo che facilita l’arrivo della riboflavina al sito principale, o forse un sito di regolazione allosterica. Serviranno altri studi per capirlo!

Il Mistero del pH: Perché RFVT3 è Diverso?
Una delle caratteristiche più intriganti è che RFVT3 funziona meglio a pH basso (acido), mentre RFVT1 e RFVT2 non sembrano curarsene. Come mai? Confrontando le strutture e facendo esperimenti, abbiamo individuato i colpevoli: due residui acidi specifici di RFVT3, l’acido aspartico 119 (D119) e l’acido glutammico 145 (E145). In RFVT1 e RFVT2, al loro posto ci sono altri aminoacidi (Cisteina 125 e Glutammina 151).
Questi due residui si trovano nella cavità centrale. La nostra ipotesi è che in ambiente acido (con più protoni H+ in giro), D119 ed E145 vengano protonati. La protonazione di D119 potrebbe disturbare le sue interazioni con l’elica TM1 (una delle “porte” del trasportatore), favorendo il legame della riboflavina e il cambiamento conformazionale. La protonazione di E145, invece, potrebbe rompere un “ponte salino” che forma con un altro residuo (Lisina 414) nello stato aperto verso l’esterno, accelerando così il passaggio allo stato occluso e poi aperto verso l’interno.
Per confermare che i protoni fossero coinvolti, abbiamo fatto un esperimento elegante usando i proteoliposomi: in pratica, abbiamo inserito le proteine RFVT purificate dentro vescicole lipidiche artificiali. Abbiamo visto che solo nei liposomi con RFVT3, l’aggiunta di riboflavina a pH acido causava un ingresso di protoni (misurato con una sonda fluorescente sensibile al pH). Questo suggerisce fortemente che RFVT3 sia un co-trasportatore: fa entrare una molecola di riboflavina insieme a uno o più protoni, sfruttando il gradiente di pH come fonte di energia!
Il Meccanismo “A Porte Girevoli” (Alternating Access)
Mettendo insieme tutti i pezzi – le strutture, le mutazioni, gli esperimenti funzionali e le simulazioni al computer (MD simulations) – possiamo ora proporre un modello più dettagliato di come funzionano questi trasportatori, basato sul meccanismo “alternating access”:
1. Apertura Esterna: Il trasportatore è aperto verso l’esterno, pronto a catturare la riboflavina. In RFVT3, il ponte salino E145-K414 aiuta a stabilizzare questa conformazione. Il sito di legame ha alta affinità per la riboflavina.
2. Legame e Occlusione: La riboflavina si lega alla tasca centrale. Questo legame, insieme alla possibile protonazione di D119 ed E145 in RFVT3 a pH acido, induce cambiamenti conformazionali. Le “porte” esterne si chiudono (stato occluso verso l’esterno, come visto in RFVT2) e poi anche quelle interne rimangono chiuse (stato completamente occluso, probabilmente transitorio).
3. Apertura Interna: Il trasportatore cambia conformazione, aprendosi verso l’interno della cellula (stato aperto verso l’interno, come visto in RFVT3). Il ponte salino E145-K414 (se presente) si rompe, e le interazioni che tenevano chiusa la porta interna si allentano. Il sito di legame cambia leggermente forma, diminuendo l’affinità per la riboflavina.
4. Rilascio: La riboflavina viene rilasciata nel citosol.
5. Ritorno alla Posizione Iniziale: Il trasportatore “vuoto” torna alla conformazione aperta verso l’esterno, pronto per un nuovo ciclo.
Implicazioni: Dalle Malattie alle Terapie Future
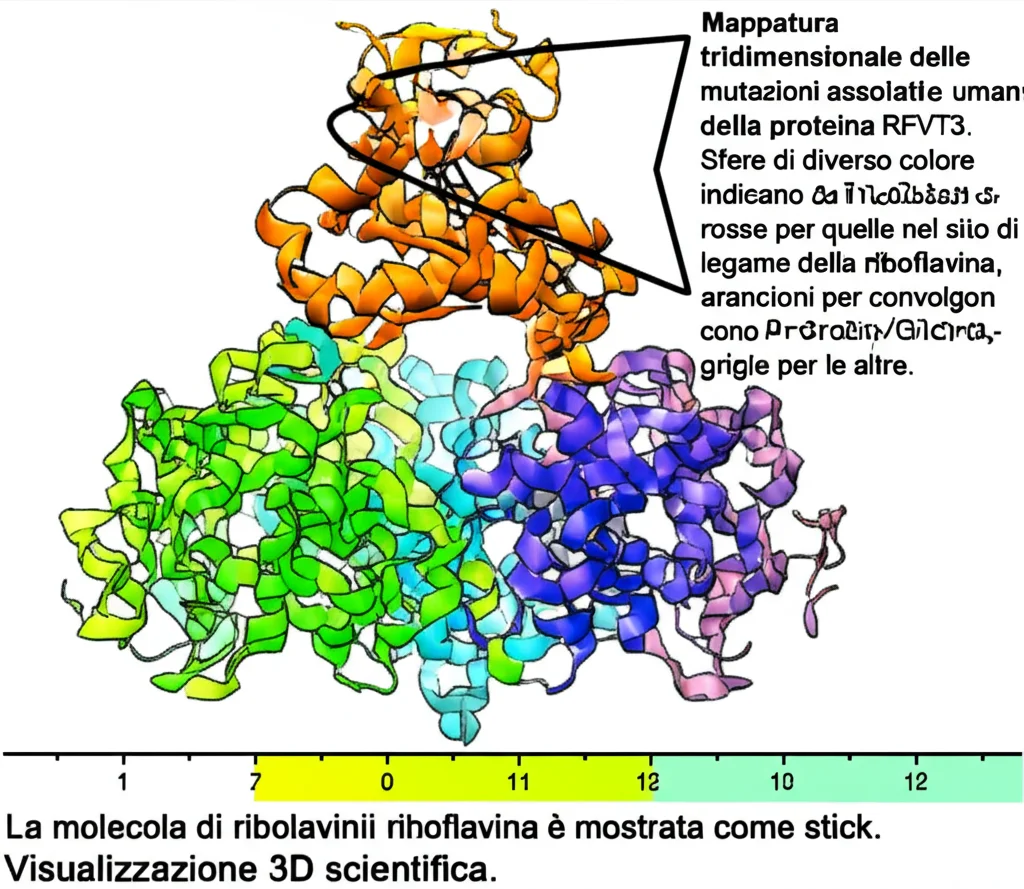
Capire come funzionano gli RFVT è fondamentale. Ci aiuta a comprendere le basi molecolari di malattie come la MADD e la sindrome di Brown-Vialetto-van Laere. Mappando le mutazioni patogene conosciute sulle nostre strutture, vediamo che molte colpiscono proprio i residui cruciali per il legame della riboflavina, per la stabilità della proteina o per i cambi conformazionali necessari al trasporto. Ad esempio, la mutazione E77K in RFVT2 probabilmente rompe un ponte salino importante per chiudere la “porta” interna.
Inoltre, la scoperta che gli RFVT sono spesso sovraespressi nei tumori e la conoscenza dettagliata della loro struttura potrebbero aprire la strada allo sviluppo di farmaci che bloccano questi trasportatori o che li usano come “cavalli di Troia” per veicolare farmaci antitumorali specificamente nelle cellule cancerose, magari coniugandoli alla riboflavina stessa.
Questo studio dimostra anche come le tecniche avanzate come la cryo-EM, combinate con approcci biochimici e computazionali, stiano aprendo nuove finestre sulla biologia molecolare, permettendoci di “vedere” e capire meccanismi cellulari incredibilmente complessi e importanti per la nostra salute. È un campo in continua evoluzione, ed è entusiasmante farne parte!
Spero che questo viaggio nel mondo dei trasportatori di riboflavina vi sia piaciuto. È incredibile pensare a quanta complessità ed eleganza ci sia dietro un processo apparentemente semplice come l’assorbimento di una vitamina!
Fonte: Springer