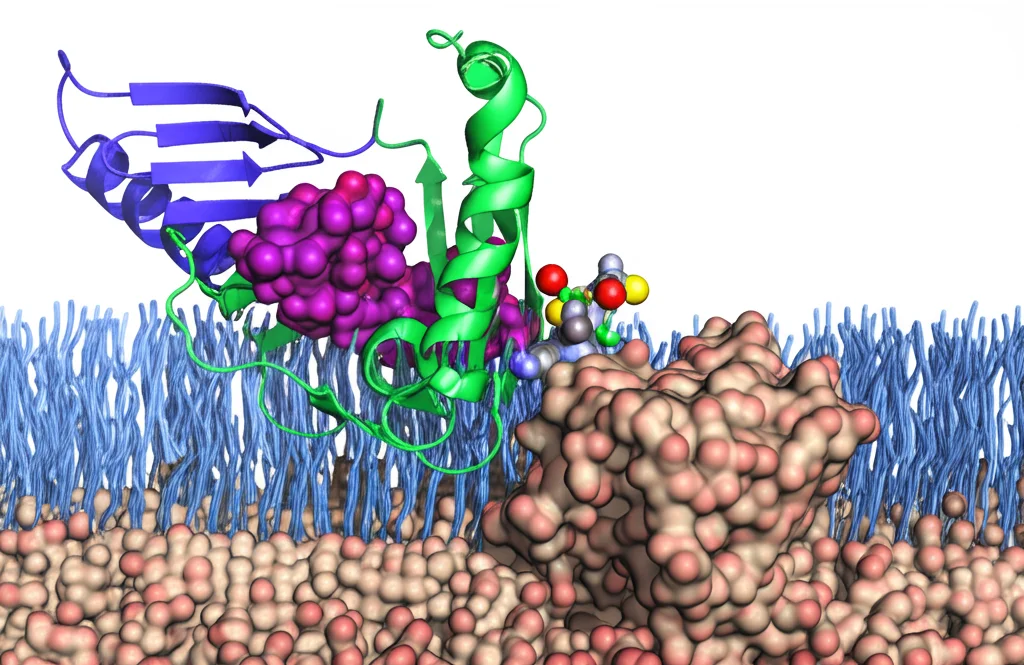
GAT3 Svelato: Viaggio nel Cuore del Cervello per Nuove Terapie Neurologiche
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico del nostro cervello, un luogo dove molecole complesse orchestrano pensieri, emozioni e movimenti. Parleremo di una proteina specifica, un “guardiano” molecolare chiamato GAT3, e di come siamo riusciti a svelarne alcuni segreti cruciali.
Il Cervello: Una Danza di Segnali
Immaginate il cervello come una rete incredibilmente intricata di comunicazione. I neuroni “parlano” tra loro usando messaggeri chimici chiamati neurotrasmettitori. Uno dei più importanti è l’acido gamma-amminobutirrico, meglio noto come GABA. Il GABA è il principale neurotrasmettitore inibitorio del nostro sistema nervoso centrale. Cosa significa? In pratica, aiuta a “calmare” l’attività neuronale, mantenendo un equilibrio fondamentale. Pensatelo come il freno del sistema: senza di esso, l’attività cerebrale potrebbe andare fuori controllo.
Quando il GABA viene rilasciato nello spazio tra due neuroni (la fessura sinaptica), svolge il suo compito calmante. Ma poi, è essenziale che venga rapidamente rimosso per permettere al sistema di “resettarsi” e prepararsi al segnale successivo. Qui entrano in gioco i trasportatori del GABA (GATs). Sono proteine specializzate che agiscono come delle pompe molecolari: catturano il GABA dalla fessura sinaptica e lo riportano all’interno delle cellule, principalmente nelle cellule gliali (astrociti) nel caso del nostro protagonista, GAT3.
GAT3: Un Attore Chiave con Implicazioni Cliniche
Il nostro GAT3, quindi, non è un semplice spazzino. Modulando la quantità di GABA disponibile, influenza direttamente la comunicazione neuronale. Non sorprende che alterazioni nel suo funzionamento siano state collegate a una serie di disturbi neurologici e malattie neurodegenerative, tra cui:
- Epilessia
- Schizofrenia
- Ansia
- Depressione
- Disturbi del sonno
- Dolore cronico
- Persino la dipendenza da alcol
Capite bene perché GAT3 sia diventato un bersaglio farmacologico così interessante. Poter modulare la sua attività, inibendola o potenziandola a seconda dei casi, potrebbe aprire la strada a nuove terapie mirate per queste condizioni.
La Sfida: Colpire il Bersaglio Giusto
C’è un però. Nel nostro corpo esistono quattro tipi di trasportatori del GABA (GAT1, GAT2, GAT3 e BGT1). GAT1 e GAT3 sono quelli prevalentemente espressi nel cervello, ma sono molto simili tra loro. Sviluppare un farmaco che colpisca selettivamente GAT3, senza influenzare troppo GAT1 (che ha anch’esso ruoli importanti), è una sfida enorme. La somiglianza strutturale rende difficile creare “chiavi” molecolari (i farmaci) che aprano solo la “serratura” GAT3.
Fino ad oggi, avevamo a disposizione inibitori con una selettività solo moderata per GAT3, come la molecola SNAP-5114. Ma per progettare farmaci migliori, più potenti e selettivi, avevamo bisogno di una cosa fondamentale: vedere GAT3 da vicino, capire la sua struttura tridimensionale a livello atomico. E qui entra in gioco il nostro lavoro.
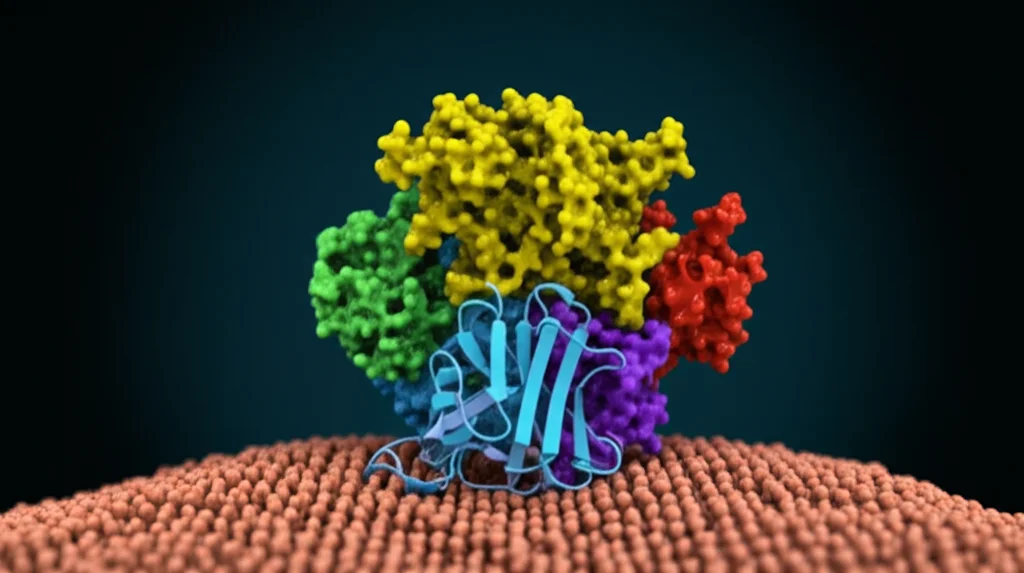
La Nostra Missione: “Fotografare” GAT3
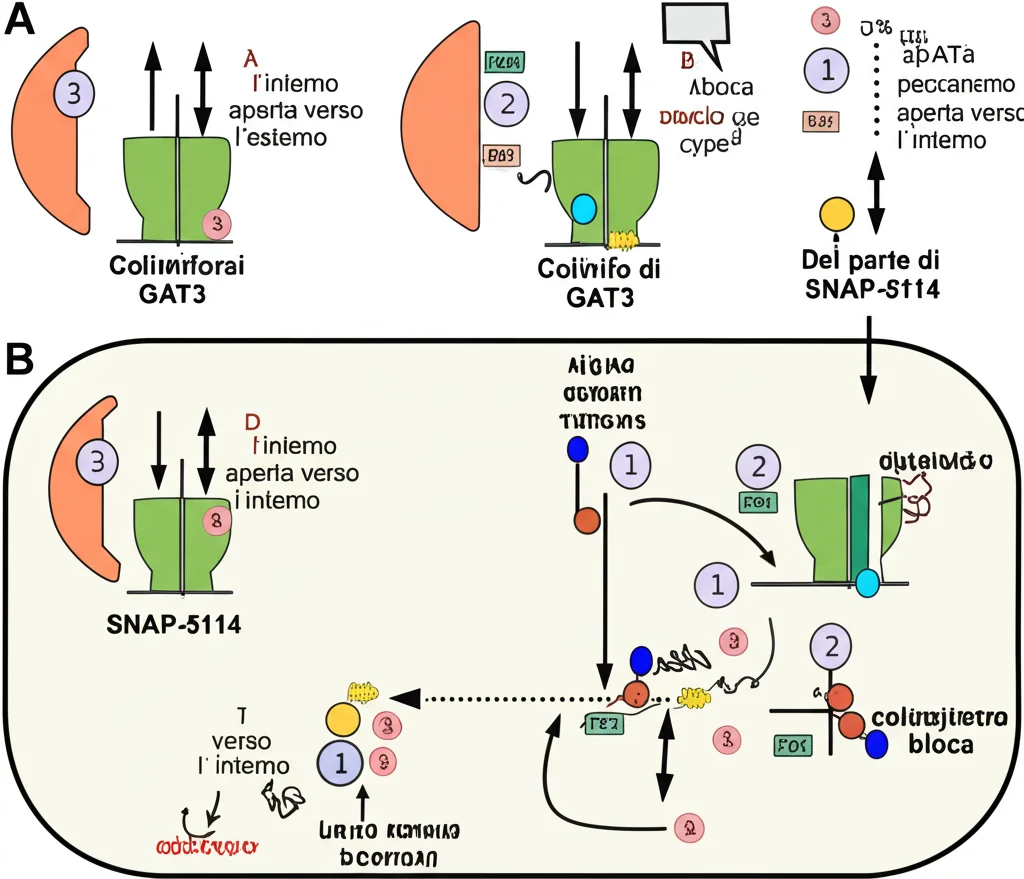
Non esisteva una struttura dettagliata di GAT3. Decifrarla è stato il nostro obiettivo primario. Abbiamo utilizzato una tecnica potentissima chiamata criomicroscopia elettronica (cryo-EM), che permette di visualizzare molecole biologiche a risoluzioni incredibili congelandole rapidamente.
Ma GAT3 è una proteina di membrana, notoriamente difficile da studiare. Per facilitare le cose, abbiamo usato un piccolo “trucco”: abbiamo modificato leggermente GAT3 inserendo un piccolo “marchio” (un epitopo) riconosciuto da un frammento di anticorpo (Fab 9D5). Questo Fab ha agito come un punto di riferimento (un marcatore fiduciale), aiutandoci a orientare le migliaia di immagini ottenute con la cryo-EM e a ricostruire la struttura finale. È importante sottolineare che abbiamo verificato che questa modifica non alterasse significativamente la funzione di GAT3 o la sua interazione con l’inibitore SNAP-5114.
Siamo riusciti a determinare non una, ma due strutture di GAT3:
- La forma “apo”, ovvero la proteina da sola, senza alcun legante.
- La forma legata all’inibitore selettivo SNAP-5114.
Le Sorprese della Struttura: Una Porta Aperta Verso l’Interno
Entrambe le strutture ci hanno riservato una sorpresa. Ci aspettavamo forse di vedere GAT3 in diverse conformazioni, magari una aperta verso l’esterno per catturare il GABA. Invece, in entrambi i casi, abbiamo trovato GAT3 bloccato in una conformazione aperta verso l’interno (inward-open). Immaginate una porta girevole bloccata in modo da permettere l’uscita ma non l’entrata.
Nella forma apo, la tasca dove normalmente si legherebbe il GABA (il sito ortosterico) è esposta verso l’interno della cellula (il citoplasma), mentre una complessa rete di interazioni molecolari tiene chiusa la “porta” esterna. Abbiamo anche identificato il sito di legame per lo ione Cloruro (Cl-), essenziale per il trasporto, ma non abbiamo visto densità chiare per gli ioni Sodio (Na+), suggerendo che forse li avesse già rilasciati all’interno.
SNAP-5114: Un Inibitore Anomalo
E la struttura con SNAP-5114? Qui la sorpresa è stata ancora maggiore. SNAP-5114 è un derivato dell’acido nipecotico (una molecola simile al GABA). Ci si potrebbe aspettare che si leghi allo stesso sito del GABA e lo blocchi competitivamente, impedendogli di entrare. E in effetti, SNAP-5114 si lega proprio lì, nel sito ortosterico.
Tuttavia, i nostri esperimenti funzionali (saggi di captazione di GABA radiomarcato) hanno rivelato che SNAP-5114 agisce come un inibitore non competitivo. Cosa significa? Un inibitore competitivo riduce l’affinità del trasportatore per il suo substrato (GABA), mentre un inibitore non competitivo riduce la velocità massima con cui il trasportatore lavora, senza influenzare l’affinità. I nostri dati cinetici (analisi di Michaelis-Menten) hanno mostrato proprio questo: all’aumentare della concentrazione di SNAP-5114, la velocità massima (Vmax) del trasporto di GABA diminuiva significativamente, mentre l’affinità (Km) rimaneva pressoché costante.
Come conciliare il legame al sito ortosterico con un’inibizione non competitiva? La nostra struttura fornisce la risposta: SNAP-5114 si lega al sito ortosterico, ma lo fa quando GAT3 è già nella conformazione aperta verso l’interno. In questo modo, intrappola il trasportatore in quello stato, impedendogli di tornare alla conformazione aperta verso l’esterno per legare nuovo GABA. È come se bloccasse la porta girevole dopo che ha completato mezzo giro.
Il Segreto della Selettività: Questione di Spazio e Ingombro
Ma perché SNAP-5114 preferisce GAT3 a GAT1? Ricordate la sfida della selettività? Abbiamo confrontato la nostra struttura di GAT3 con quelle note di GAT1. Sebbene il sito di legame sia molto conservato, ci sono alcune differenze chiave in quattro amminoacidi (E66, C316, V413, C414 in GAT3 vs Y60, S302, C399, T400 in GAT1).
Inizialmente abbiamo pensato che E66 (l’equivalente di Y60 in GAT1, cruciale per la selettività di un altro farmaco, la tiagabina, verso GAT1) fosse la chiave anche per SNAP-5114. Ma mutando E66 in Y nel nostro GAT3, l’inibizione da parte di SNAP-5114 non cambiava molto!
Abbiamo quindi mutato gli altri tre residui (C316S, V413C, C414T), singolarmente o insieme. E bingo! Il mutante triplo ha mostrato una resistenza a SNAP-5114 circa 20-30 volte maggiore rispetto al GAT3 normale. Questo suggerisce che sono proprio queste differenze, insieme a una tasca di legame leggermente più voluminosa in GAT3 (dovuta a un diverso posizionamento di alcune eliche transmembrana), a permettere l’alloggiamento della parte più “ingombrante” di SNAP-5114 (i suoi tre anelli fenilici). GAT1, con una tasca leggermente più stretta e residui diversi, non riesce ad accomodare SNAP-5114 altrettanto bene. La selettività, quindi, sembra derivare da una combinazione di volume della tasca e interazioni specifiche con questi residui non conservati.
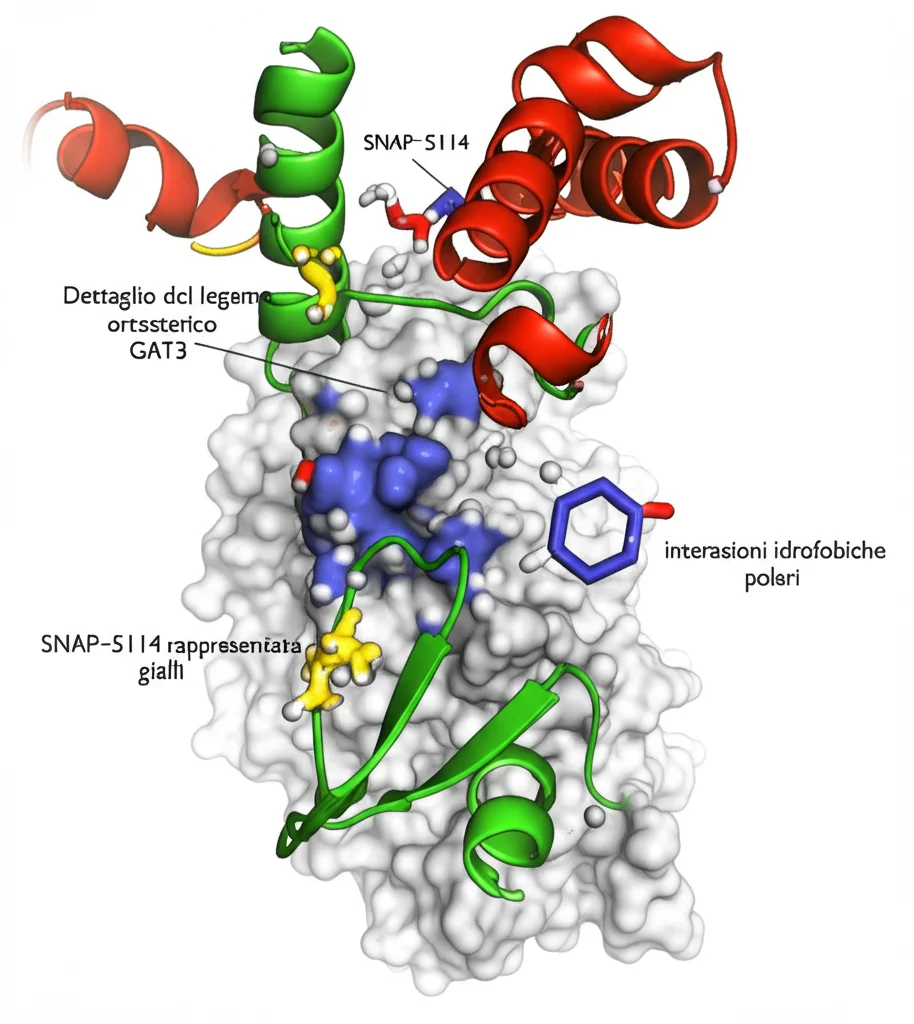
Un Modello per l’Inibizione Non Competitiva
Basandoci sulla struttura e sui dati funzionali, abbiamo proposto un modello a “due fasi” per l’azione di SNAP-5114, simile a quanto ipotizzato per la tiagabina su GAT1:
- SNAP-5114 si lega inizialmente a GAT3 quando è in conformazione aperta verso l’esterno (anche se forse molto rapidamente).
- Questo legame induce o accelera la transizione alla conformazione occlusa e poi a quella aperta verso l’interno.
- Una volta raggiunta la conformazione aperta verso l’interno, gli ioni Na+ vengono rilasciati, ma SNAP-5114 (e lo ione Cl-) rimane legato, bloccando GAT3 in questo stato inattivo.
Questo meccanismo spiega elegantemente come un legame al sito ortosterico possa portare a un’inibizione di tipo non competitivo.
Implicazioni Future: Progettare Farmaci su Misura
Cosa significa tutto questo in pratica? Il nostro studio fornisce la prima “mappa” dettagliata di GAT3 e svela come un inibitore selettivo, SNAP-5114, esercita la sua azione in modo inaspettato. Questa conoscenza è fondamentale per diversi motivi:
- Comprensione dei Meccanismi: Ci aiuta a capire meglio come funziona GAT3 e come viene regolato.
- Drug Design Razionale: Fornisce un modello strutturale su cui basare la progettazione di nuovi farmaci. Ora possiamo “vedere” dove si lega SNAP-5114 e quali interazioni sono importanti. Questo permette di modificare la molecola in modo mirato per migliorarne la potenza, la selettività e le proprietà farmacologiche.
- Nuove Strategie Terapeutiche: Apre la strada allo sviluppo di inibitori di GAT3 più efficaci e selettivi per trattare epilessia, disturbi dell’umore, dolore e altre condizioni neurologiche. Potrebbe anche guidare la ricerca di *attivatori* di GAT3, che potrebbero essere utili in altre situazioni come lesioni cerebrali o dipendenze.
Certo, c’è ancora lavoro da fare. Non siamo riusciti a ottenere la struttura con un altro modulatore (Isatin), forse perché lega con bassa affinità o stabilizza una conformazione (aperta verso l’esterno) più difficile da catturare nelle nostre condizioni sperimentali. Inoltre, dovremo confermare questi risultati in un ambiente più simile a quello cellulare (es. nanodischi lipidici).
Ma il primo passo, fondamentale, è stato fatto. Abbiamo aperto una finestra sulla struttura e sulla funzione di GAT3, rivelando un meccanismo di inibizione affascinante e fornendo gli strumenti per disegnare la prossima generazione di farmaci mirati a questo importante bersaglio terapeutico. È un esempio perfetto di come la ricerca di base, spinta dalla curiosità di capire come funzionano le cose a livello molecolare, possa avere implicazioni concrete per la salute umana. Spero che questo viaggio nel microscopico vi sia piaciuto!
Fonte: Springer