Svelando i Segreti di AftB: Nuove Armi Contro la Tubercolosi?
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico dei batteri, in particolare di uno piuttosto famigerato: il Mycobacterium tuberculosis (Mtb), il responsabile della tubercolosi. Sapete, questa malattia è ancora una delle più letali al mondo, e la comparsa di ceppi resistenti ai farmaci rende la sfida ancora più ardua. Ma noi ricercatori non ci arrendiamo facilmente!
La Fortezza del Batterio: La Parete Cellulare
Uno dei segreti della “cattiveria” di Mtb è la sua incredibile parete cellulare. Immaginatevela come una vera e propria fortezza, ricca di lipidi e zuccheri complessi, che lo protegge sia dal nostro sistema immunitario sia da molti antibiotici. È una struttura pazzesca, e capire come viene costruita è fondamentale per trovare nuovi modi per abbatterla.
All’interno di questa fortezza ci sono due componenti chiave a base di zuccheri: l’arabinogalattano (AG) e il lipoarabinomannano (LAM). Entrambi contengono delle intricate ramificazioni di uno zucchero chiamato arabinosio, che formano i cosiddetti domini di arabinano. Questi domini sono essenziali per la struttura e la funzione della parete. Pensate che l’AG fa da ponte tra lo strato più esterno di acidi micolici (altri lipidi unici di questi batteri) e lo strato più interno di peptidoglicano (che dà forma alla cellula). Il LAM, invece, è coinvolto nell’interazione con le nostre cellule immunitarie. Insomma, senza arabinano, la fortezza crolla!
Il Muratore Finale: L’Enzima AftB
La costruzione di questi domini di arabinano è un processo complesso, affidato a una squadra di enzimi specializzati chiamati arabinofuranosiltransferasi (AraTs). Ognuno ha il suo compito preciso nell’aggiungere mattoncini di arabinosio (Araf) alla catena in crescita. Il “mattone” di base viene fornito da una molecola chiamata DPA (β-D-arabinofuranosil-1-monofosforildecaprenolo), l’unico donatore di arabinosio conosciuto.
Tra questi enzimi “muratori”, ce n’è uno che gioca un ruolo cruciale proprio alla fine del processo: si chiama AftB. È lui che aggiunge gli ultimissimi residui di arabinosio, quelli terminali, con un legame specifico chiamato β-(1→2). Questo passaggio è fondamentale:
- Nell’AG, crea un motivo terminale (chiamato Araf6) che serve come punto di aggancio per gli acidi micolici, completando lo scudo protettivo.
- Nel LAM, aggiunge questi zuccheri terminali sia a strutture ramificate che lineari.
Senza AftB, la parete cellulare non è completa e funzionale, e infatti questo enzima è essenziale per la sopravvivenza del batterio. Ecco perché è diventato un bersaglio super interessante per nuovi farmaci anti-tubercolosi! Il problema? Fino ad ora, non sapevamo quasi nulla di come fosse fatto e come funzionasse a livello molecolare. Un vero rompicapo.
Finalmente una Foto! La Struttura di AftB con la Crio-EM
Ed è qui che entriamo in gioco noi! Per capire come funziona AftB, dovevamo “vederlo”. Ma come si fa a fotografare una proteina così piccola, per di più incastrata nella membrana cellulare? Abbiamo usato una tecnica potentissima chiamata crio-microscopia elettronica (cryo-EM). In pratica, abbiamo congelato rapidamente delle copie purificate dell’enzima (abbiamo usato quello di un “cugino” meno pericoloso, il Mycobacterium chubuense, che è molto simile) e le abbiamo bombardate con elettroni per ottenere migliaia di immagini da diverse angolazioni. Poi, con computer super potenti, abbiamo ricostruito la sua struttura 3D ad altissima risoluzione.
Per facilitare le cose, dato che AftB è una proteina di membrana (difficile da maneggiare!), l’abbiamo inserita in “zattere” lipidiche artificiali chiamate nanodischi e abbiamo usato dei piccoli frammenti di anticorpi (Fab) per “etichettarla” e renderla più visibile.

E voilà! Abbiamo ottenuto due strutture: una di AftB “vuoto” (apo) a 2.9 Å di risoluzione, e una con un analogo del suo substrato donatore (una versione modificata del DPA, chiamata 2F-FPA) legato all’interno, a 3.4 Å. Cosa abbiamo scoperto?
AftB ha una struttura tipica delle glicosiltransferasi di tipo GT-C (una famiglia di enzimi che lavorano sulle membrane), con ben 11 eliche che attraversano la membrana (il dominio TM) e una sorta di “cappuccio” che sporge all’esterno della cellula (il dominio periplasmatico, PD).
Una Cavità a Tubo per Due Substrati
La scoperta più intrigante è stata una cavità a forma di tubo, piuttosto irregolare, che attraversa l’enzima. Questa cavità sembra collegare due zone importanti:
- Un’apertura verso la membrana lipidica, da dove pensiamo entri il substrato donatore DPA (che ha una lunga coda lipidica).
- Un’apertura più ampia verso lo spazio periplasmatico (l’esterno della cellula batterica), dove potrebbe legarsi il substrato accettore, cioè la catena di arabinano in crescita (AG o LAM).
Questa architettura è geniale! Permette all’enzima di pescare il donatore dalla membrana e l’accettore dallo spazio esterno, portandoli vicini nel cuore catalitico per far avvenire la reazione. Abbiamo anche usato simulazioni al computer (dinamica molecolare, MD) per vedere come i substrati interagiscono con l’enzima, e i risultati confermano che tendono a legarsi proprio in queste due zone della cavità.
Dentro il Sito Attivo: Come AftB Afferra i Suoi Mattoni
La struttura con l’analogo del donatore (2F-FPA) ci ha dato una visione ancora più dettagliata. Abbiamo visto esattamente come questa molecola si incastra nella cavità. La sua “testa” zuccherina punta verso il fondo della tasca, dove si trova un residuo amminoacidico cruciale: un aspartato in posizione 62 (D62). Questo D62 fa parte di un motivo “DD” conservato in molti enzimi simili ed è risultato assolutamente essenziale: modificandolo, l’enzima perde completamente la sua attività!
Altri residui importanti (R221, R372, T91, T274, E172) aiutano a tenere fermo il donatore nella posizione corretta, interagendo con il suo gruppo fosfato e con l’anello di arabinosio. Anche questi residui sono conservati in diverse specie di micobatteri e modificarli blocca l’attività dell’enzima. È come vedere la chiave (il substrato) entrare perfettamente nella serratura (l’enzima)!
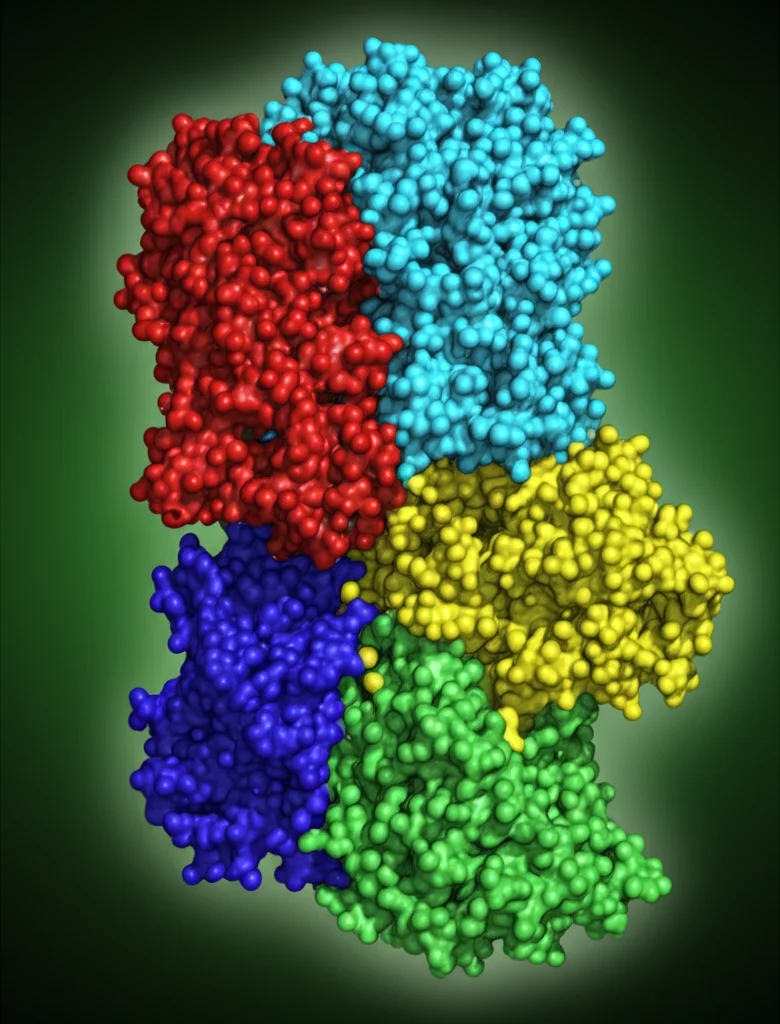
Confrontando la struttura vuota con quella legata al substrato, abbiamo notato anche dei cambiamenti di forma. L’enzima si “stringe” leggermente attorno al donatore, con un movimento a pinza del dominio PD verso la membrana. È come se l’enzima si adattasse per accogliere al meglio il suo ospite.
Il Meccanismo d’Azione: Un Doppio Spostamento Elegante
Ok, abbiamo la struttura, sappiamo dove si legano i substrati, ma come avviene esattamente la reazione chimica? AftB è un enzima “ritenente”, il che significa che la configurazione dello zucchero arabinosio che trasferisce rimane la stessa (beta) nel prodotto finale. Ci sono due modi principali in cui gli enzimi ritenenti possono funzionare: un meccanismo “front-face SNi” o un meccanismo a “doppio spostamento”.
Nel nostro caso, la posizione del D62, a soli 3.8 Å dal carbonio chiave (C1) dello zucchero nel donatore, è perfetta per agire come un “nucleofilo”: può attaccare direttamente questo carbonio. Questo ci ha fatto propendere per il meccanismo a doppio spostamento. Ecco come pensiamo funzioni:
1. Primo attacco: Il D62 (deprotonato, carico negativamente) attacca il C1 del donatore DPA. Questo rompe il legame tra lo zucchero e il fosfato (stabilizzato da R221 e R372) e forma un legame temporaneo tra lo zucchero e l’enzima (un intermedio covalente Araf-enzima). In questo passaggio, la configurazione dello zucchero si inverte (diventa alfa).
2. Secondo attacco: Il gruppo ossidrile (OH) in posizione C2 del substrato accettore (la catena di arabinano) attacca a sua volta il C1 dello zucchero legato all’enzima. Questo rompe il legame zucchero-enzima e forma il nuovo legame β-(1→2) tra l’accettore e lo zucchero trasferito. La configurazione dello zucchero torna ad essere beta, come nel donatore originale. Voilà, reazione completata!
Questo meccanismo a due tempi è elegante e spiega bene come AftB riesca a mantenere la stereochimica dello zucchero, usando il D62 come attore protagonista.
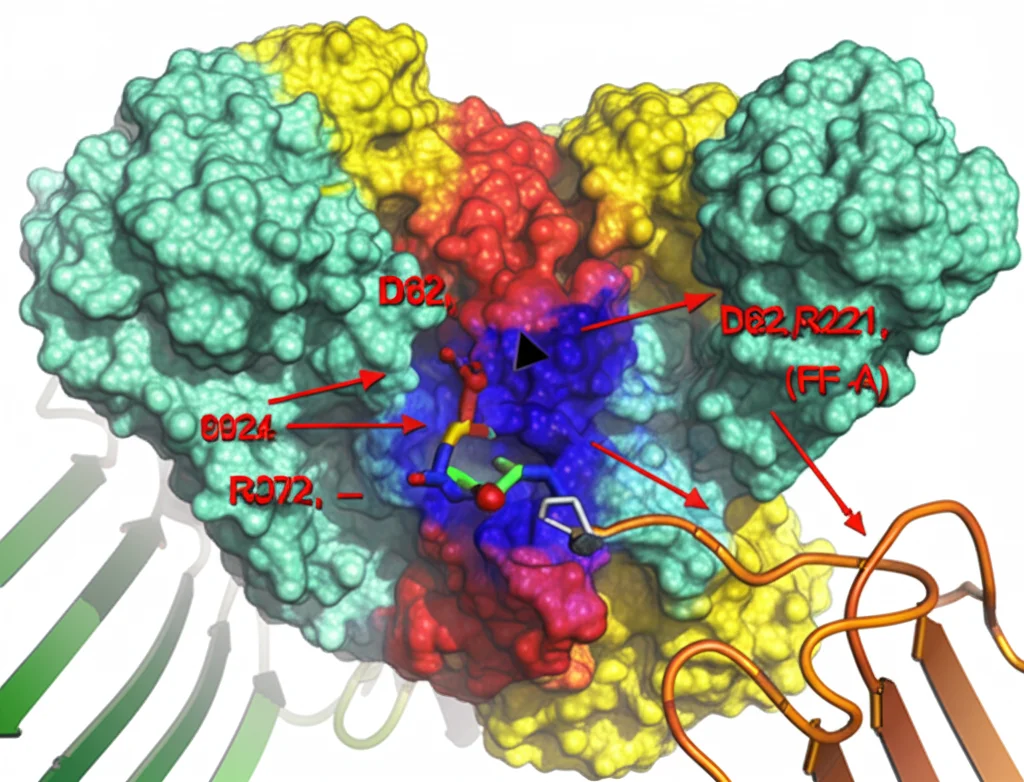
Implicazioni per la Lotta alla Tubercolosi
Perché tutto questo lavoro è così importante? Beh, innanzitutto, abbiamo finalmente capito come funziona uno degli enzimi essenziali per la costruzione della parete cellulare dei micobatteri. E la cosa fantastica è che la struttura di AftB e i suoi residui chiave sono incredibilmente conservati anche nel Mycobacterium tuberculosis! Questo significa che le nostre scoperte sul cugino M. chubuense sono direttamente applicabili al batterio che causa la TB.
AftB è un bersaglio farmacologico promettente. Inibire questo enzima significa bloccare la costruzione della parete, indebolendo il batterio o addirittura uccidendolo. Studi precedenti hanno mostrato che ridurre i livelli di AftB rende Mtb più sensibile ad altri antibiotici come la rifampicina.
Ora che conosciamo la forma tridimensionale di AftB e, soprattutto, la forma della sua cavità di legame per i substrati, abbiamo una mappa dettagliata per progettare nuove molecole che possano incastrarsi lì dentro e bloccare l’attività dell’enzima. Potremmo sviluppare inibitori competitivi che mimano i substrati naturali o molecole che semplicemente “tappano” la cavità.
Questo apre strade entusiasmanti per lo sviluppo di nuovi farmaci anti-TB, potenzialmente efficaci anche contro i ceppi resistenti, e magari utili anche contro altre infezioni da micobatteri non tubercolari (NTM), che stanno diventando un problema crescente.
Insomma, svelare la struttura di AftB è stato come trovare una nuova porta segreta nella fortezza del batterio della tubercolosi. Ora abbiamo gli strumenti per provare a forzarla e, speriamo, contribuire a vincere la battaglia contro questa malattia. Il viaggio è appena iniziato, ma le prospettive sono davvero promettenti!
Fonte: Springer