Stress nel Reticolo Endoplasmatico? La Comunicazione Cellulare Va in Tilt!
Ciao a tutti! Oggi voglio parlarvi di qualcosa di affascinante che succede dentro le nostre cellule, un meccanismo fondamentale che, quando va storto, può avere conseguenze serie per la nostra salute. Parliamo di comunicazione cellulare e di come uno stato di “stress” interno possa mandare tutto all’aria.
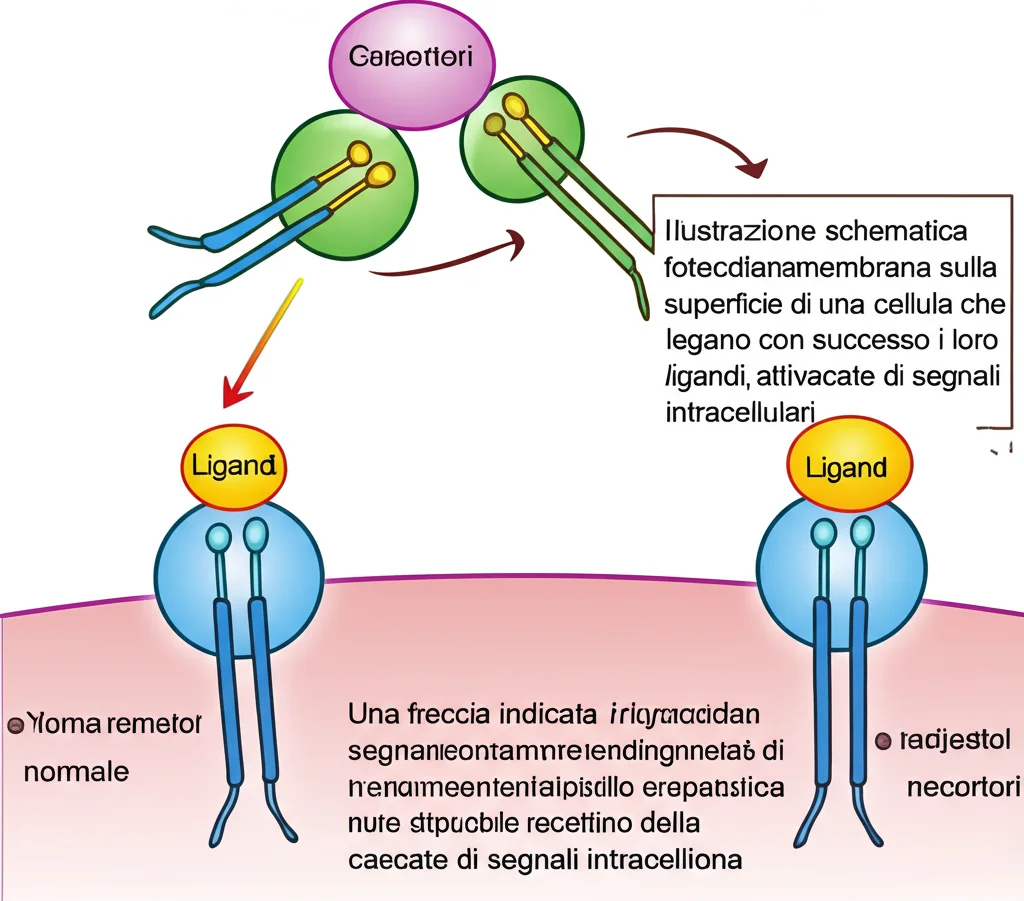
Immaginate le nostre cellule come città incredibilmente complesse e indaffarate. Per funzionare, devono comunicare costantemente tra loro e con l’ambiente esterno. Come fanno? Usano speciali “antenne” sulla loro superficie, chiamate recettori transmembrana. Queste antenne captano segnali chimici (come ormoni o fattori di crescita, i cosiddetti ligandi polipeptidici) e trasmettono il messaggio all’interno della cellula, innescando una risposta.
Ma dove vengono costruite e preparate queste antenne? Qui entra in gioco una struttura cellulare cruciale: il reticolo endoplasmatico (ER), insieme all’apparato di Golgi. Pensatelo come una sofisticata fabbrica e centro di smistamento. È qui che le proteine destinate alla superficie cellulare, come i nostri recettori, vengono piegate nella loro forma corretta (un processo chiamato folding), modificate, maturate e infine spedite alla loro destinazione finale sulla membrana cellulare.
Ma cosa succede quando la fabbrica va in tilt? Lo Stress del Reticolo Endoplasmatico (ER Stress)
A volte, la cellula si trova a dover produrre troppe proteine, oppure le proteine prodotte sono difettose e non riescono a piegarsi correttamente. Questo accumulo di proteine “sbagliate” nel reticolo endoplasmatico crea una situazione di stress, nota appunto come ER stress. È come se la catena di montaggio della nostra fabbrica fosse sovraccarica e piena di prodotti difettosi.
Questo ER stress non è una cosa rara; è coinvolto in un sacco di guai, come malattie neurodegenerative, cancro e molte altre patologie. La cellula, ovviamente, non sta a guardare. Attiva una risposta di emergenza chiamata Unfolded Protein Response (UPR), un complesso sistema di controllo qualità che cerca di ripristinare l’ordine: rallenta la produzione generale di proteine, aumenta la capacità di piegare correttamente quelle rimaste e, se il danno è troppo grave, può persino indurre la cellula a “suicidarsi” (apoptosi) per il bene dell’organismo. I protagonisti di questa risposta sono sensori come IRE1α, PERK e ATF6, normalmente tenuti a bada da una proteina chaperonina chiamata BiP. Quando c’è stress, BiP corre a dare una mano alle proteine malpiegate, liberando i sensori che attivano la UPR.
Il Problema Nascosto: I Recettori Vanno Fuori Gioco
Finora, si sapeva molto sull’ER stress in generale, ma l’effetto specifico sui nostri recettori transmembrana, le antenne di comunicazione, era un territorio in gran parte inesplorato. Ed è qui che la faccenda si fa interessante! Abbiamo iniziato a sospettare che proprio questi recettori potessero essere particolarmente sensibili allo stress dell’ER. Perché?
- Sono prodotti in quantità relativamente piccole rispetto ad altre proteine, come quelle della matrice extracellulare.
- Hanno spesso strutture complesse e sono “instabili”, richiedendo un folding molto preciso e l’aiuto costante di chaperoni.
- Hanno un turnover rapido: vengono continuamente prodotti, usati e poi degradati, quindi la loro produzione costante li rende vulnerabili a problemi nella “fabbrica” ER.
La nostra ipotesi era: e se l’ER stress, sovraccaricando il sistema, impedisse ai recettori di maturare correttamente e raggiungere la superficie cellulare? Se così fosse, la cellula diventerebbe “sorda” ai segnali esterni, con conseguenze potenzialmente disastrose.

Le Prove: Viaggio in Tre Malattie Diverse
Per verificare questa idea, abbiamo esaminato tre modelli di malattie note per essere associate all’ER stress: il mieloma multiplo (MM), la leucemia linfatica cronica (LLC) e l’osteogenesi imperfetta (OI).
Nel mieloma multiplo, le cellule tumorali (plasmacellule) sono iperproduttive, secernendo enormi quantità di anticorpi. Questo le mette sotto un costante stress ER. In alcuni pazienti, è sovraespresso un recettore chiamato FGFR3. Abbiamo trattato cellule di mieloma con sostanze che inducono artificialmente l’ER stress (come tunicamicina, brefeldina A, tapsigargina) o con un farmaco usato in terapia, il bortezomib (che causa anche ER stress). Risultato? In tutti i casi, la quantità di FGFR3 maturo sulla superficie cellulare diminuiva drasticamente, e le cellule non rispondevano più al segnale del suo ligando (FGF2). In pratica, l’antenna FGFR3 veniva “ritirata” o non arrivava proprio in superficie.
Passiamo all’osteogenesi imperfetta, una malattia genetica che causa fragilità ossea. Qui, il problema spesso risiede in mutazioni del collagene di tipo I, che si accumula malpiegato nell’ER degli osteoblasti (le cellule che costruiscono l’osso), causando forte stress. Abbiamo usato un modello murino di OI (il topo Aga2) e analizzato i recettori importanti per la funzione ossea: FGFR1, LRP6 (un co-recettore per la via di segnalazione WNT) e PTH1R (recettore per l’ormone paratiroideo). Anche qui, lo stress ER endogeno portava a una riduzione dei recettori maturi sulla superficie cellulare (FGFR1, LRP6) o a un’alterata proporzione tra forme mature e immature (PTH1R), suggerendo problemi nel loro processamento e trasporto. Abbiamo anche visto che inducendo ER stress in cellule in coltura, i recettori LRP6 e FZD5 (un altro recettore WNT) non maturavano correttamente, bloccando la segnalazione WNT.

Infine, nella leucemia linfatica cronica, le cellule B tumorali mostrano segni di ER stress costitutivo. Ci siamo concentrati su un recettore chiamato ROR1, importante per la sopravvivenza di queste cellule tumorali e bersaglio terapeutico. Analizzando campioni di pazienti, abbiamo visto che livelli più alti di marcatori di ER stress correlavano con una maggiore ritenzione intracellulare di forme immature di ROR1. Meno ROR1 maturo in superficie significa, potenzialmente, una minore efficacia delle terapie mirate a questo recettore.
Si Può Rimediare? Strategie per Ripristinare la Comunicazione
La buona notizia è che questo effetto negativo dell’ER stress sulla comunicazione cellulare non sembra essere irreversibile. Abbiamo fatto alcuni esperimenti per vedere se potevamo “salvare” i recettori.
- Potenziare la risposta adattativa: Aumentando artificialmente i livelli della chaperonina BiP (uno degli “aiutanti” nel folding delle proteine), siamo riusciti a contrastare l’effetto negativo dell’ER stress indotto dalla tunicamicina, ripristinando parzialmente la presenza di FGFR3 maturo sulla superficie cellulare. È come dare più personale qualificato alla fabbrica in difficoltà.
- Usare “chaperoni chimici”: Trattando le cellule con TUDCA (acido tauroursodesossicolico), una molecola nota per alleviare l’ER stress, abbiamo visto un recupero sia dei livelli di recettori maturi (FGFR3 e FGFR1) sulla superficie, sia della capacità delle cellule di rispondere ai loro ligandi (FGF2).
- Ligandi più “forti”: In alcuni casi, usare una versione più stabile e potente del ligando (come FGF2-STAB) riusciva a compensare parzialmente la riduzione dei recettori in superficie, ottenendo comunque una risposta cellulare. È come “alzare la voce” per farsi sentire anche da un’antenna meno efficiente.
Conclusioni: Un Nuovo Livello di Complessità
Quello che emerge da questi studi è un aspetto prima poco apprezzato dell’ER stress: il suo impatto diretto sulla comunicazione cellulare attraverso l’alterato processamento dei recettori transmembrana. Non si tratta di un effetto limitato a un singolo recettore o tipo cellulare, ma sembra essere un fenomeno più generale che colpisce diverse vie di segnalazione (FGFR, WNT, ROR1, PTH1R).
Questo ha implicazioni enormi:
- Comprensione delle malattie: Molte patologie associate all’ER stress potrebbero avere una componente legata a questa “sordità” cellulare acquisita. Ad esempio, nell’OI, l’alterata segnalazione FGF e WNT dovuta all’ER stress potrebbe contribuire ai difetti ossei.
- Terapie mirate: Se una terapia si basa sull’azione di un farmaco su un recettore di superficie (come anticorpi monoclonali o inibitori specifici), l’ER stress nella cellula bersaglio potrebbe ridurne l’efficacia semplicemente perché ci sono meno recettori disponibili! Questo è cruciale da considerare nello sviluppo e nell’applicazione di farmaci personalizzati.
- Nuove strategie terapeutiche: Alleviare l’ER stress (ad esempio con molecole come TUDCA) potrebbe diventare una strategia per ripristinare la normale comunicazione cellulare e forse aumentare l’efficacia di altre terapie. Al contrario, in alcuni tipi di cancro, indurre selettivamente ER stress potrebbe essere benefico per ridurre l’espressione di recettori oncogenici.
Insomma, abbiamo scoperto che lo stress interno della cellula può letteralmente “tagliare le comunicazioni” con l’esterno, agendo sulle sue antenne. È un meccanismo affascinante che aggiunge un nuovo tassello alla nostra comprensione di come funzionano le cellule, sia in salute che in malattia, e apre nuove strade per future terapie. Un’ulteriore dimostrazione di quanto sia intricata e meravigliosa la biologia!
Fonte: Springer