Cuore Sotto Attacco: Come STING Peggiora i Danni Post-Infarto (e Come Fermarlo!)
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi affascina e che riguarda il nostro motore vitale: il cuore. Sapete, quando si parla di infarto, la corsa contro il tempo per riaprire le arterie coronarie è fondamentale. Sembra la soluzione perfetta, no? Riaprire il flusso sanguigno per salvare il muscolo cardiaco. Eppure, c’è un paradosso crudele: proprio questa riapertura, la cosiddetta riperfusione, può causare ulteriori danni. È un fenomeno noto come danno da ischemia-riperfusione (MI/R), e purtroppo contribuisce ancora a tassi di mortalità elevati, anche con le tecnologie più avanzate. Capire a fondo cosa succede in questa fase è cruciale per trovare nuovi modi di proteggere il cuore e migliorare la sopravvivenza dei pazienti.
Il Problema: Danno da Riperfusione
Immaginate il muscolo cardiaco come un campo che ha sofferto la siccità (l’ischemia, la mancanza di sangue e ossigeno). Quando finalmente arriva l’acqua (la riperfusione), invece di portare solo sollievo, un’ondata troppo violenta può erodere il terreno e fare più danni. Nel cuore succede qualcosa di simile: il ritorno improvviso di ossigeno e sangue innesca una serie di reazioni a catena, tra cui stress ossidativo, infiammazione e, come stiamo scoprendo sempre di più, forme specifiche di morte cellulare. Per decenni abbiamo cercato un “interruttore” magico per fermare questo danno secondario, ma senza un successo clinico definitivo. C’è chiaramente bisogno di scavare più a fondo.
Un Nuovo Attore Entra in Scena: La Ferroptosi
Negli ultimi anni, i riflettori si sono accesi su un tipo particolare di morte cellulare chiamata ferroptosi. Come suggerisce il nome, è una morte che dipende dal ferro e da un accumulo eccessivo di “ruggine” a livello delle membrane cellulari (perossidazione lipidica). Abbiamo scoperto che la ferroptosi gioca un ruolo chiave proprio nel danno da MI/R. Esiste una proteina fondamentale che ci protegge da questo processo: si chiama GPX4 (Glutatione Perossidasi 4). GPX4 agisce come uno scudo, neutralizzando i composti lipidici pericolosi. Studi precedenti avevano già notato che durante il danno da MI/R, i livelli di GPX4 calano drasticamente, proprio mentre la ferroptosi prende il sopravvento. Aumentare GPX4, infatti, sembra proteggere il cuore. Ma la domanda rimaneva: cosa causa la scomparsa di GPX4 in queste condizioni? Qual è il meccanismo che regola la sua degradazione?
STING: Un Insospettabile “Cattivo” nel Cuore
Ed è qui che entra in gioco un protagonista inaspettato: la proteina STING (Stimulator of Interferon Genes). Normalmente, STING fa parte di un sistema di sorveglianza immunitaria (insieme al suo compagno cGAS) che rileva la presenza di DNA fuori posto all’interno della cellula, come quello virale o batterico, e scatena una risposta infiammatoria per difenderci. Ma cosa succede durante un MI/R? Il danno alle cellule cardiache, in particolare ai mitocondri (le centrali energetiche della cellula), causa il rilascio di frammenti di DNA (dsDNA) nel citoplasma. Questo DNA “anomalo” viene riconosciuto da cGAS, che produce un messaggero (cGAMP) che a sua volta attiva STING. Sorprendentemente, abbiamo scoperto che questo segnale dsDNA-cGAS-STING si accumula proprio nelle cellule muscolari del cuore (i cardiomiociti, o CMs) durante l’MI/R, e questo coincide con alti tassi di ferroptosi! Sembra quasi che un meccanismo di difesa si sia trasformato in un’arma a doppio taglio.
La Prova del Nove: Cosa Succede Senza STING?
Per capire se STING fosse davvero il colpevole, abbiamo fatto degli esperimenti mirati. Utilizzando modelli animali (topi), abbiamo creato delle versioni geneticamente modificate in cui il gene per cGAS o per STING era specificamente eliminato solo nei cardiomiociti (li abbiamo chiamati cgas-CKO e Sting-CKO). Questi topi sono stati poi sottoposti a un modello sperimentale di MI/R. I risultati sono stati netti: i topi senza cGAS o STING nei loro cardiomiociti mostravano un’area di necrosi cardiaca significativamente ridotta, una migliore funzione cardiaca (misurata con parametri come la frazione di eiezione, EF, e la frazione di accorciamento, FS) e una minore fibrosi (la formazione di tessuto cicatriziale) rispetto ai topi normali. Al contrario, attivando artificialmente STING, il danno da MI/R peggiorava. Questo ci ha dato una forte indicazione: la via cGAS-STING nei cardiomiociti gioca un ruolo dannoso nell’MI/R.
STING e Ferroptosi: Un Legame Pericoloso
Ma come fa STING a peggiorare il danno? Abbiamo analizzato più a fondo cosa succedeva a livello molecolare. Nei topi normali sottoposti a MI/R, vedevamo un aumento dello stress ossidativo (come l’accumulo di specie reattive dell’ossigeno, ROS) e della perossidazione lipidica (misurata tramite un marcatore chiamato MDA), entrambi segni distintivi della ferroptosi. Inoltre, i livelli della proteina protettiva GPX4 erano bassi. Nei topi Sting-CKO, invece, lo stress ossidativo e la perossidazione lipidica erano ridotti, e i livelli di GPX4 erano più alti! Analisi più complesse (RNA-seq) hanno confermato che nei cuori con STING attivo, i geni legati alla ferroptosi e all’autofagia (un processo di “pulizia” cellulare) erano particolarmente accesi. Questo ci ha suggerito che STING non solo promuove la ferroptosi, ma lo fa specificamente influenzando i livelli di GPX4, forse attraverso l’autofagia.
Il Meccanismo Svelato: STING “Mangia” GPX4 via Autofagia
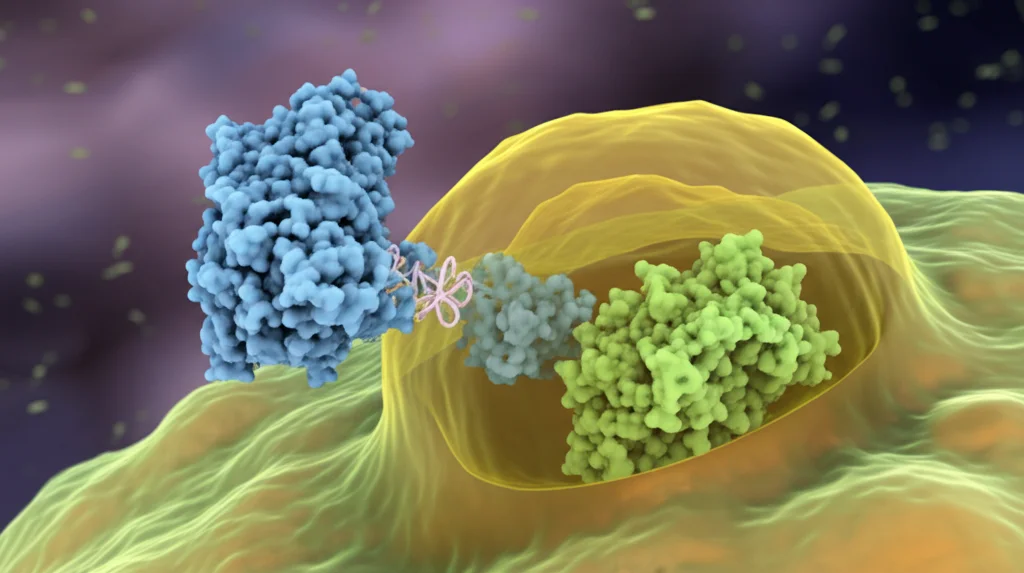
Qui arriva la parte più intrigante della scoperta. Ci siamo chiesti se STING potesse interagire direttamente con GPX4. Utilizzando tecniche di biologia molecolare (come la co-immunoprecipitazione, Co-IP), abbiamo dimostrato che, sì, STING e GPX4 si legano fisicamente l’una all’altra all’interno delle cellule cardiache, specialmente dopo uno stress come l’MI/R o l’attivazione di STING con cGAMP. Siamo riusciti persino a identificare i “punti di contatto” precisi: l’aminoacido T267 di STING si lega all’aminoacido N146 di GPX4. È come una stretta di mano molecolare specifica!
Ma perché questo legame porta alla scomparsa di GPX4? La risposta sembra essere nell’autofagia. STING, una volta attivato e legato a GPX4, sembra “etichettare” GPX4 per la degradazione attraverso il sistema autofagico-lisosomiale. In pratica, STING facilita il reclutamento di GPX4 negli autofagosomi (i “sacchi della spazzatura” cellulari) e promuove la loro fusione con i lisosomi (gli “inceneritori” cellulari), dove GPX4 viene distrutto. Abbiamo visto che bloccando la fusione tra autofagosomi e lisosomi (con un inibitore chiamato Bafilomicina A1), si impediva la degradazione di GPX4 indotta da STING. Al contrario, bloccando le fasi iniziali dell’autofagia o la degradazione tramite proteasoma, non si otteneva lo stesso effetto protettivo su GPX4. Quindi, STING orchestra attivamente la distruzione di GPX4 usando la macchina dell’autofagia.
Un Circolo Vizioso e Come Spezzarlo
Questo meccanismo crea un pericoloso circolo vizioso: il danno da MI/R attiva STING -> STING si lega a GPX4 e ne causa la degradazione via autofagia -> la mancanza di GPX4 aumenta la ferroptosi -> la ferroptosi causa più danno cellulare e stress ossidativo -> questo può ulteriormente attivare STING. Un loop che auto-alimenta il danno cardiaco.
La buona notizia? Se capiamo il meccanismo, possiamo provare a interromperlo! Abbiamo testato due strategie terapeutiche nei nostri modelli animali:
- Potenziare GPX4: Abbiamo usato un virus reso innocuo (AAV) per veicolare copie extra del gene GPX4 direttamente nelle cellule cardiache dei topi. Questo ha aumentato i livelli di GPX4 e, anche quando STING veniva attivato artificialmente (con DMXAA), il cuore era protetto dal danno da MI/R, con meno ferroptosi e una migliore funzione cardiaca.
- Inibire STING: Abbiamo usato un farmaco sperimentale, H-151, che blocca specificamente STING. Somministrando H-151 ai topi prima dell’MI/R, abbiamo osservato una riduzione significativa del danno cardiaco, livelli più stabili di GPX4, meno ferroptosi e una migliore funzionalità del cuore. H-151 sembrava impedire l’interazione tra STING e GPX4 e bloccare il flusso autofagico anomalo.
Entrambe le strategie si sono dimostrate promettenti, suggerendo che sia potenziare GPX4 sia bloccare STING potrebbero essere vie terapeutiche valide.
Dalla Provetta al Paziente: Rilevanza Clinica
Tutto questo è molto interessante in laboratorio, ma ha una rilevanza per i pazienti umani? Sembrerebbe di sì. Abbiamo analizzato campioni di siero di pazienti che avevano subito un intervento di angioplastica coronarica (PCI) per un infarto. Abbiamo scoperto che, dopo l’intervento (quindi dopo la riperfusione), i livelli di STING nel siero aumentavano, mentre quelli di GPX4 diminuivano. Questo andamento rispecchia esattamente quello che avevamo osservato nei modelli animali. Inoltre, esperimenti su cellule cardiache umane derivate da cellule staminali embrionali hanno confermato che lo stress da anossia/riossigenazione (che mima l’MI/R) induceva un aumento di STING e una diminuzione di GPX4. Questi dati suggeriscono che l’asse STING-GPX4 sia attivo e potenzialmente importante anche nel cuore umano durante l’ischemia-riperfusione.
In conclusione, il nostro viaggio ci ha portato a scoprire un meccanismo nuovo e inaspettato attraverso cui il danno da ischemia-riperfusione si aggrava. Abbiamo identificato STING come un attore chiave che, attivato dal DNA rilasciato dalle cellule danneggiate, si lega direttamente alla proteina protettiva GPX4 e ne orchestra la distruzione tramite autofagia. Questa perdita di GPX4 scatena la ferroptosi nei cardiomiociti, contribuendo in modo significativo al danno cardiaco. La cosa entusiasmante è che questa scoperta apre nuove strade terapeutiche: bloccare STING o aumentare i livelli di GPX4 potrebbero diventare strategie concrete per proteggere il cuore dei pazienti dopo un infarto. C’è ancora molta strada da fare, ma aver identificato questo asse STING-GPX4 ci dà una nuova speranza e un bersaglio preciso su cui lavorare per difendere il nostro muscolo più prezioso.
Fonte: Springer