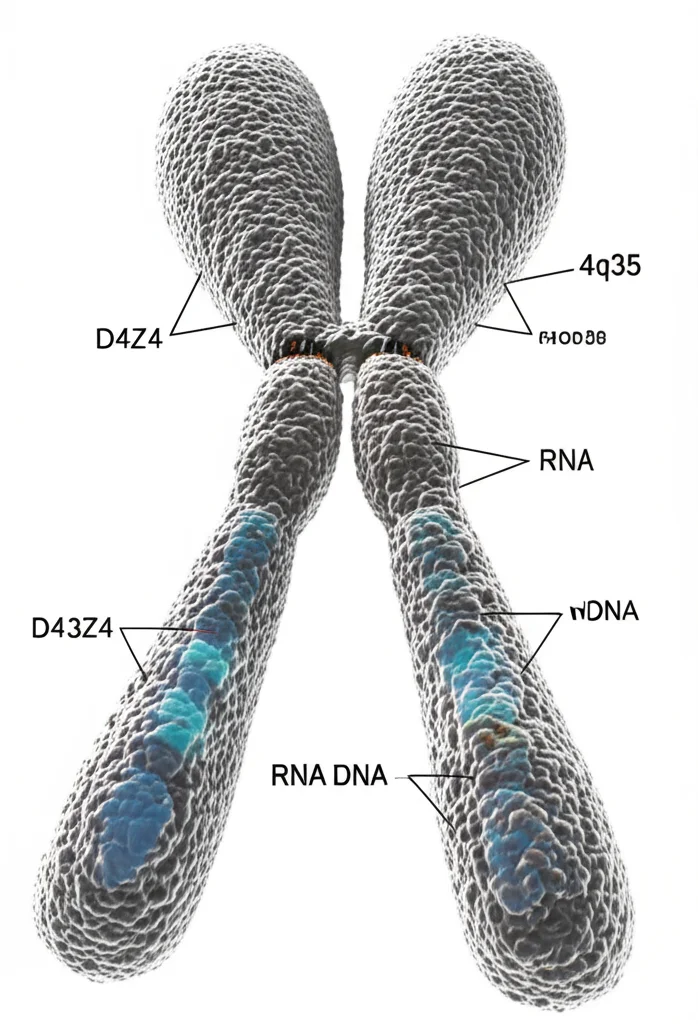
DNA Sotto Stress: Come il Cromosoma 4q35 Risponde ai Danni e Svela Segreti sulla FSHD
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel cuore del nostro genoma, in una regione specifica che da tempo incuriosisce scienziati e medici: il cromosoma 4q35. Perché è così interessante? Beh, perché una sua particolarità, la riduzione di copie di una sequenza ripetuta chiamata macrosatellite D4Z4, è legata a una malattia muscolare chiamata Distrofia Facio-Scapolo-Omerale, o FSHD.
Per anni, l’idea dominante è stata che la perdita di queste ripetizioni D4Z4 cambiasse la struttura della cromatina (quel complesso di DNA e proteine che impacchetta il nostro genoma) in quella zona, portando all’attivazione “sbagliata” di geni vicini, in particolare uno chiamato DUX4, considerato il principale colpevole della malattia. Sembrava un quadro abbastanza chiaro, no? Meno ripetizioni D4Z4, più DUX4, uguale malattia.
Le Complessità Nascoste del Modello FSHD
Eppure, come spesso accade nella scienza, la realtà si è rivelata molto più sfumata. Accumulando dati clinici ed epidemiologici, e con l’avvento di nuove tecnologie genomiche, ci siamo resi conto che questo modello “unificante”, pur valido, non spiegava tutto. Ad esempio, perché alcune persone con la firma molecolare della FSHD (poche ripetizioni D4Z4 e una variante specifica che stabilizza l’RNA di DUX4) non sviluppano mai la malattia o la manifestano in forme lievissime (la cosiddetta penetranza incompleta)? E come mai questa configurazione genetica “a rischio” è presente in circa il 2% della popolazione, una frequenza piuttosto alta per una malattia genetica considerata rara?
Queste domande mi hanno spinto a pensare che forse dovevamo guardare al locus 4q35 con occhi diversi. Non solo come un interruttore on/off per DUX4, ma come una regione dinamica, capace di rispondere all’ambiente cellulare, agli stress, e magari regolata in modi più complessi di quanto immaginassimo. E se la lunghezza delle ripetizioni D4Z4 avesse un ruolo più sottile, modulando la risposta dell’intera regione a stimoli esterni?
Un’Esplorazione Dettagliata del Vicinato 4q35
Così, armato di curiosità e degli strumenti della biologia molecolare, ho deciso di indagare più a fondo. Abbiamo analizzato diversi geni in questa regione, sia quelli più lontani dalle ripetizioni D4Z4 (verso il centromero, come SLC25A4, FAT1 e FRG1) sia quelli più vicini (verso il telomero, come FRG2, un RNA non codificante chiamato DBE-T e gli stessi trascritti derivati dalle ripetizioni D4Z4, che abbiamo chiamato D4Z4-T). Abbiamo usato cellule primarie umane: mioblasti (precursori delle cellule muscolari) e cellule derivate da trofoblasto (importanti nello sviluppo embrionale), sia da individui sani (controllo) che da pazienti FSHD con un numero ridotto di ripetizioni D4Z4 (che chiameremo DRA, D4Z4 Reduced Allele).
La prima cosa che abbiamo notato è che questa regione non è tutta uguale. I geni più lontani (SLC25A4, FAT1) mostravano segni tipici di geni attivi nella loro cromatina (marche istoniche come acetilazione e H3K4me3). Invece, man mano che ci avvicinavamo alle ripetizioni D4Z4, la situazione cambiava. FRG1 e soprattutto FRG2 avevano un profilo “bivalente” o “poised”, con un mix di marche attivatorie e repressive, come se fossero pronti a rispondere ma tenuti a freno. Infine, le stesse ripetizioni D4Z4 e la regione DBE-T erano immerse in un ambiente di eterocromatina, tipicamente repressivo (con marche come H3K9me3 e H3K27me3). Insomma, il 4q35 è un quartiere genomico con zone ben distinte!

La Risposta allo Stress: Un Comportamento Inaspettato
A questo punto, la domanda chiave era: come reagisce questo quartiere complesso agli stimoli esterni? Abbiamo provato a “disturbare” le cellule con vari farmaci. Prima, inibitori di enzimi che modificano la cromatina (come TSA, che blocca le deacetilasi istoniche, o PJ34, che inibisce PARP1, un enzima coinvolto nella riparazione del DNA e nella struttura della cromatina). Poi, agenti genotossici veri e propri, che causano danni al DNA (come cisplatino, etoposide e doxorubicina – DOXO).
I risultati sono stati sorprendenti! Mentre i geni più lontani (SLC25A4, FAT1, FRG1) non cambiavano molto o venivano leggermente repressi dallo stress genotossico, i geni più vicini al telomero (FRG2, DBE-T e D4Z4-T) si accendevano prepotentemente! E la cosa ancora più intrigante era che l’entità di questa “accensione” era inversamente correlata al numero di ripetizioni D4Z4: nelle cellule FSHD (con meno ripetizioni), l’aumento di questi RNA era significativamente maggiore rispetto alle cellule di controllo. Era come se la riduzione delle D4Z4 rendesse quella zona più “sensibile” allo stress.
Abbiamo anche visto che in risposta al danno al DNA (indotto da DOXO), nella regione D4Z4 si accumulavano marcatori di danno (come γH2AX) e proteine associate alla risposta al danno (come macroH2A1.1), soprattutto nelle cellule FSHD. Questo suggerisce che gli alleli con meno ripetizioni D4Z4 potrebbero essere intrinsecamente più vulnerabili o accessibili ai fattori di risposta al danno.
Il Mistero dell’Aumento: Non Trascrizione, Ma Stabilizzazione!
Ma come avveniva questo aumento di RNA telomerici (FRG2, DBE-T, D4Z4-T) in risposta allo stress? Istintivamente, si pensa a un aumento della trascrizione: la cellula inizia a “leggere” di più quei geni. Abbiamo controllato le modifiche istoniche associate all’attivazione trascrizionale (come l’acetilazione) dopo il trattamento con DOXO, ma… sorpresa! Non c’era un aumento significativo di queste marche attivatorie. Anzi, in alcuni casi vedevamo persino un aumento di marche repressive come H3K9me3! Un paradosso: più RNA, ma con segni di repressione sulla cromatina?
Questo ci ha fatto sospettare un meccanismo diverso: e se non fosse la produzione ad aumentare, ma la degradazione a diminuire? In altre parole, se questi RNA diventassero più stabili in risposta allo stress? Per verificarlo, abbiamo usato un trucco: abbiamo bloccato completamente la trascrizione con un farmaco chiamato Actinomicina D (ActD) e poi abbiamo aggiunto lo stress (DOXO). Se l’aumento fosse dovuto a nuova trascrizione, non avremmo dovuto vedere alcun effetto con ActD. Invece, abbiamo visto che i livelli di FRG2, DBE-T e D4Z4-T aumentavano anche in presenza di ActD e DOXO!
Misurando poi l’emivita di questi RNA (quanto tempo impiegano a dimezzarsi nella cellula), abbiamo confermato: in risposta allo stress genotossico, questi RNA specifici diventano molto più longevi, specialmente nelle cellule con meno ripetizioni D4Z4. Quindi, il meccanismo chiave non è (solo) trascrizionale, ma post-trascrizionale: lo stress stabilizza questi RNA, impedendone la normale degradazione. Un fenomeno affascinante e inaspettato!
RNA che Amano la Cromatina
C’era un’altra caratteristica comune a questi RNA telomerici (FRG2, DBE-T, D4Z4-T). Molti RNA derivati da sequenze ripetute o non codificanti non se ne vanno in giro per la cellula, ma rimangono associati alla cromatina da cui sono stati trascritti, magari svolgendo ruoli strutturali o regolatori proprio lì. Abbiamo fatto esperimenti di frazionamento cellulare e immunoprecipitazione di RNA legato alla cromatina (ChRIP). Risultato? Bingo! FRG2, DBE-T e D4Z4-T sono risultati essere prevalentemente associati alla frazione della cromatina, in particolare a quella marcata da modifiche repressive come H3K9me3 e H3K27me3. Questo li accomuna ad altri RNA noti per interagire con l’eterocromatina, come i trascritti TERRA dai telomeri.
Quindi, questi RNA non solo vengono stabilizzati dallo stress, ma vivono “attaccati” alla cromatina repressiva. Che ruolo giocano lì? Aiutano a mantenere la struttura silente? O partecipano in qualche modo alla risposta al danno? Sono domande aperte che stimolano nuove ricerche.
Differenze tra Cellule in Proliferazione e Differenziate
Un’altra osservazione interessante è emersa quando abbiamo confrontato i mioblasti (cellule proliferative) con i miotubi (cellule differenziate, più simili alle fibre muscolari mature). Abbiamo indotto i mioblasti a differenziarsi (notando peraltro che quelli FSHD faticavano un po’ di più a farlo, come già noto) e poi li abbiamo trattati con gli agenti genotossici. Ebbene, nei miotubi differenziati, la risposta di stabilizzazione degli RNA telomerici allo stress era quasi assente! Questo suggerisce che questo meccanismo di risposta sia specifico delle cellule in attiva divisione. Forse è un sistema di allerta o di gestione dello stress particolarmente importante durante fasi dinamiche come la proliferazione o lo sviluppo?
Implicazioni e Prospettive Future: Oltre il Modello Semplice
Cosa significa tutto questo? Il nostro studio aggiunge tasselli importanti al puzzle complesso della regione 4q35 e della FSHD.
- Dimostra che il locus 4q35 non è monolitico, ma ha sottodomini funzionali con risposte diverse agli stimoli.
- Identifica un gruppo di RNA telomerici (FRG2, DBE-T, D4Z4-T) con caratteristiche comuni: sono associati alla cromatina repressiva e vengono stabilizzati post-trascrizionalmente in risposta allo stress genotossico.
- Svela che la lunghezza delle ripetizioni D4Z4 modula l’intensità di questa risposta allo stress, con gli alleli più corti (FSHD) che mostrano una risposta amplificata.
Questo apre scenari nuovi. La stabilizzazione di questi RNA in risposta a danni al DNA potrebbe essere un meccanismo di segnalazione o avere conseguenze funzionali ancora da scoprire. Il fatto che la lunghezza di D4Z4 influenzi questo processo collega direttamente la variabilità genetica individuale (il numero di ripetizioni) alla risposta cellulare a fattori ambientali (lo stress genotossico). Potrebbe questo contribuire alla variabilità clinica osservata nella FSHD? Potrebbero stress ambientali o fisiologici (come l’infiammazione, l’ossidazione) innescare o peggiorare la malattia in individui predisposti attraverso meccanismi simili?
Inoltre, ci ricorda che le sequenze ripetute nel nostro genoma, spesso considerate “DNA spazzatura”, sono tutt’altro che inerti. Il macrosatellite D4Z4 è un esempio lampante di come queste regioni possano influenzare l’espressione genica locale e la risposta cellulare in modi complessi e dinamici, modulati dalla loro stessa dimensione. Chissà quanti altri macrosatelliti nel nostro genoma hanno ruoli simili ancora da scoprire?
La ricerca continua, ovviamente. Vogliamo capire esattamente come avviene questa stabilizzazione, quali proteine sono coinvolte, e qual è la funzione precisa di questi RNA accumulati. Ma aver scoperto questo legame tra lunghezza delle ripetizioni, stress genotossico e stabilità dell’RNA apre una finestra affascinante sulla biologia del locus 4q35 e, potenzialmente, su nuovi approcci per comprendere e forse un giorno trattare la FSHD. È un promemoria di quanto ancora dobbiamo imparare dalle regioni più enigmatiche del nostro DNA!
Fonte: Springer