SIGMAR1: La Chiave Nascosta nelle Cellule Staminali del Cancro al Polmone?
Ciao a tutti! Oggi voglio parlarvi di una ricerca che mi ha davvero appassionato e che potrebbe aprire scenari interessanti nella lotta contro uno dei big killer a livello mondiale: il cancro al polmone. Come sapete, questa malattia è purtroppo la prima causa di morte per cancro, e nonostante i progressi nelle terapie, la prognosi per molti pazienti rimane ancora difficile. Uno dei motivi principali? Le recidive e le metastasi, quei nemici subdoli che compaiono anche dopo che il tumore sembrava sconfitto.
Il Mistero delle Cellule Staminali Tumorali (CST)
Da qualche tempo, nel mondo della ricerca oncologica, si parla sempre più insistentemente della “teoria delle cellule staminali tumorali” (o CSCs, dall’inglese Cancer Stem Cells). Cosa significa? Immaginate che all’interno del tumore ci sia una piccola popolazione di cellule “madri”, le CST appunto, che hanno caratteristiche simili alle normali cellule staminali del nostro corpo. Queste cellule speciali hanno due capacità fondamentali:
- Auto-rinnovamento: Possono generare copie identiche di sé stesse, mantenendo così la “riserva” di cellule staminali tumorali.
- Differenziamento: Possono dare origine a tutte le altre cellule tumorali “comuni” che formano la massa principale del tumore.
Si pensa che siano proprio queste CST le responsabili delle recidive e delle metastasi. Perché? Perché spesso sono resistenti alle terapie convenzionali (chemioterapia, radioterapia). Magari il trattamento riesce a eliminare la maggior parte delle cellule tumorali, facendo regredire il tumore, ma se anche poche CST sopravvivono, queste possono “risvegliarsi” e rigenerare l’intero tumore, magari anche a distanza di tempo o in altri organi. Capite bene che riuscire a identificare e colpire specificamente queste cellule sarebbe un passo da gigante per ottenere una cura definitiva. Il problema è che non conosciamo ancora a fondo queste cellule nel cancro al polmone.
La Nostra Strategia: Computer e Provette al Lavoro
Per cercare di svelare qualcosa in più sulle CST polmonari, abbiamo deciso di adottare un approccio combinato, unendo la potenza dell’analisi computazionale (*in silico*) con la verifica sperimentale in laboratorio (*in vitro*).
Come modello di studio *in vitro*, abbiamo usato una linea cellulare molto conosciuta nel campo della ricerca sul cancro al polmone (in particolare per il non-piccolo carcinoma polmonare, NSCLC, la forma più comune), chiamata A549. Queste cellule, se coltivate in condizioni particolari (su piastre speciali che non le fanno aderire), formano delle aggregazioni sferiche chiamate “tumorsfere”. È noto che queste tumorsfere si arricchiscono proprio di cellule con caratteristiche simili alle CST: esprimono marcatori tipici delle staminali (come CD44, ALCAM, SOX2, NANOG) e mostrano una maggiore capacità di auto-rinnovarsi. Quindi, le tumorsfere derivate dalle A549 sono diventate il nostro modello “vivente” di CST polmonari putative.
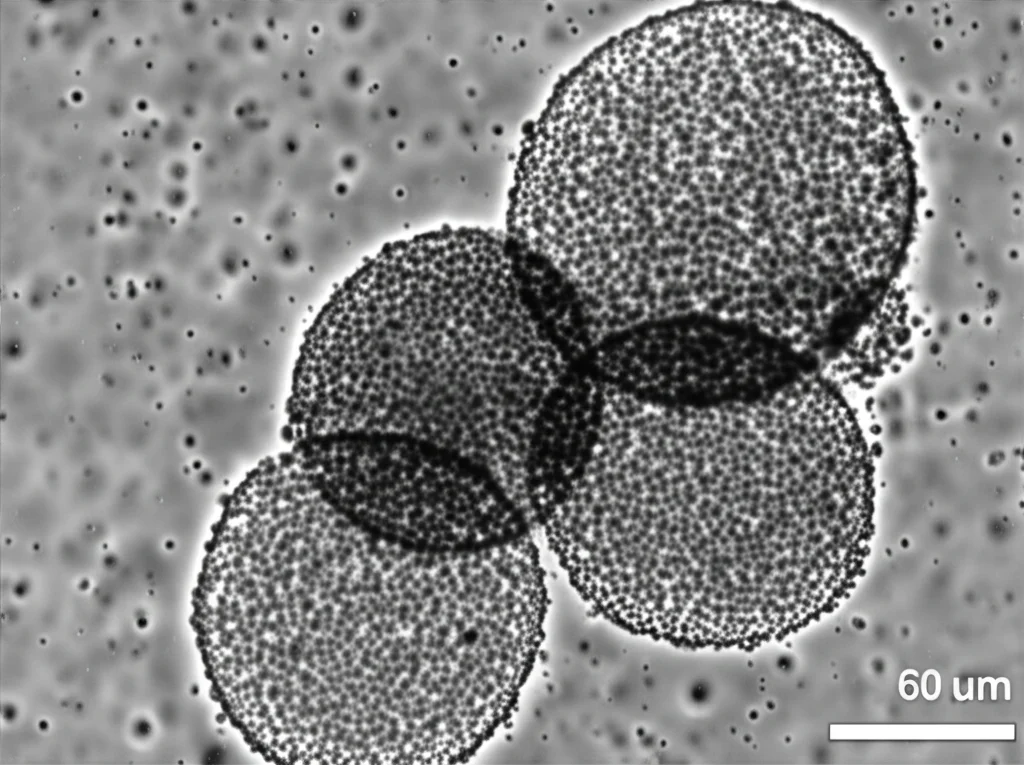
Scavando nei Dati: L’Analisi *In Silico*
Parallelamente, ci siamo tuffati nell’analisi di dati già esistenti, provenienti da studi che avevano analizzato il profilo genetico di singole cellule tumorali prelevate da pazienti con cancro al polmone NSCLC (analisi di single-cell RNA sequencing, o scRNA-seq). Questo tipo di analisi è potentissimo perché, a differenza delle analisi tradizionali che guardano al tumore nel suo insieme (un mix eterogeneo di cellule tumorali, immunitarie, ecc.), ci permette di vedere cosa succede all’interno di *ogni singola cellula tumorale*.
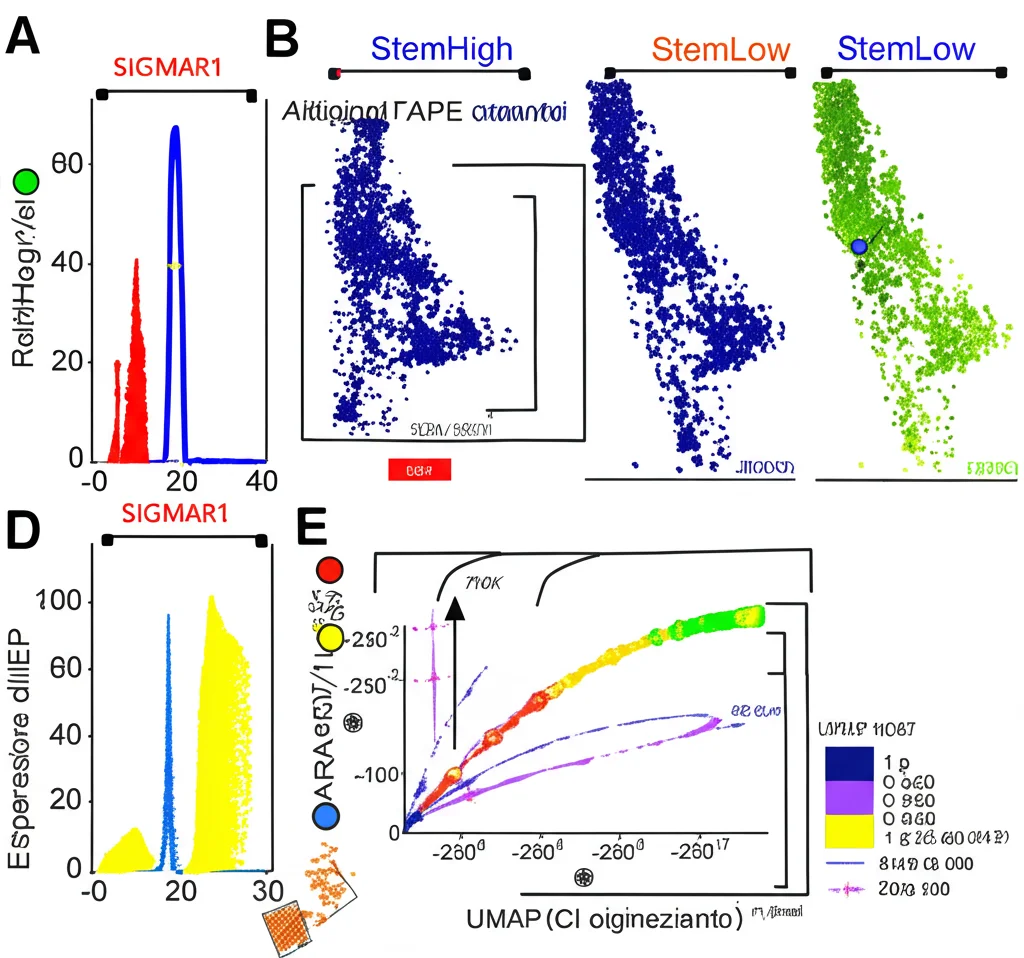
Abbiamo rianalizzato due grandi dataset pubblici di scRNA-seq, concentrandoci sulle cellule tumorali di pazienti il cui tumore non presentava mutazioni del gene EGFR (similmente alle nostre A549). Usando algoritmi bioinformatici, abbiamo cercato di identificare, all’interno della popolazione tumorale, le cellule con le caratteristiche più “staminali” (le abbiamo chiamate “StemHigh”) distinguendole da quelle più “differenziate” (“StemLow”). E abbiamo avuto conferma: le cellule StemHigh esprimevano livelli più alti dei marcatori di CST già noti (MYC, ALCAM, EPCAM, CD44).
La Scoperta: Emerge SIGMAR1
A questo punto, ci siamo chiesti: ci sono geni espressi in modo significativamente più alto nelle cellule StemHigh rispetto alle StemLow, e che magari non erano ancora stati associati in modo così specifico alle CST polmonari? Confrontando i geni sovraespressi nelle StemHigh in entrambi i dataset, ne abbiamo trovati 15 in comune. Tra questi, uno ha attirato particolarmente la nostra attenzione: SIGMAR1 (Sigma Non-opioid Intracellular Receptor 1).
Perché proprio SIGMAR1? Analizzando un altro database pubblico (il TCGA), abbiamo visto che i pazienti con cancro al polmone (adenocarcinoma, LUAD) che avevano alti livelli di espressione di SIGMAR1 nel loro tumore avevano una prognosi peggiore, cioè una sopravvivenza più bassa. Questo suggeriva un possibile ruolo importante di SIGMAR1 nella progressione della malattia.
Inoltre, abbiamo fatto un’analisi “temporale” virtuale (trajectory analysis) sui dati scRNA-seq. Questa analisi cerca di ricostruire il percorso di differenziamento delle cellule, dall’origine (le cellule più staminali) verso stati più differenziati. Ebbene, abbiamo osservato che le cellule all’origine di questi percorsi erano arricchite proprio di SIGMAR1, e che l’espressione di questo gene diminuiva man mano che le cellule procedevano lungo il percorso di differenziamento, parallelamente alla diminuzione di altri marcatori staminali come ALCAM e MYC. Tutto sembrava puntare nella stessa direzione!
La Conferma in Laboratorio: SIGMAR1 è Cruciale per le Tumorsfere
Era il momento di tornare al bancone del laboratorio e verificare se quello che avevamo visto nei dati computazionali trovava riscontro nel nostro modello *in vitro*. Abbiamo quindi misurato l’espressione di SIGMAR1 nelle nostre tumorsfere A549 e l’abbiamo confrontata con quella delle cellule A549 cresciute in modo tradizionale (aderenti alla piastra). I risultati sono stati chiari: sia a livello di mRNA (il messaggero genetico) che di proteina, SIGMAR1 era significativamente più espresso nelle tumorsfere, proprio come ci aspettavamo per un marcatore di CST! Anche la proteina CD44, nostro marcatore di controllo, era aumentata nelle tumorsfere, confermando la natura staminale di queste strutture.
Ma SIGMAR1 è solo un marcatore passivo o ha un ruolo attivo nel mantenere le proprietà staminali? Per rispondere a questa domanda cruciale, abbiamo usato una tecnica chiamata “silenziamento genico” con siRNA. In pratica, abbiamo introdotto nelle cellule A549 delle piccole molecole (siRNA) disegnate specificamente per bloccare la produzione della proteina SIGMAR1. Abbiamo usato due siRNA diversi per essere più sicuri che gli effetti osservati fossero dovuti proprio alla mancanza di SIGMAR1 e non ad effetti collaterali indesiderati (“off-target”).
Abbiamo visto che il silenziamento di SIGMAR1 non influenzava in modo significativo la vitalità o il numero delle cellule A549 cresciute in modo aderente. Ma cosa succedeva alla loro capacità di formare tumorsfere, cioè alla loro capacità di auto-rinnovamento? Qui l’effetto è stato netto: le cellule in cui avevamo silenziato SIGMAR1 formavano tumorsfere significativamente più piccole rispetto alle cellule di controllo. Questo suggerisce fortemente che SIGMAR1 gioca un ruolo chiave nel regolare la capacità di auto-rinnovamento delle CST polmonari.
Non solo: analizzando l’espressione genica nelle tumorsfere formate da cellule con SIGMAR1 silenziato, abbiamo visto che anche l’espressione di altri importanti marcatori associati alle CST, come ALCAM, MYC e ALDH1A1, era significativamente ridotta.

SIGMAR1: Un Potenziale Bersaglio Terapeutico?
Mettendo insieme i pezzi del puzzle, sia dall’analisi *in silico* che dagli esperimenti *in vitro*, emerge un quadro affascinante: SIGMAR1 sembra essere non solo un marcatore espresso preferenzialmente nelle cellule simili a CST del cancro al polmone, ma anche un regolatore funzionale della loro capacità di auto-rinnovamento.
Questa scoperta è entusiasmante perché apre la porta a nuove strategie terapeutiche. Se riuscissimo a sviluppare farmaci che bloccano specificamente la funzione di SIGMAR1 nelle CST, potremmo forse eliminare queste cellule “madri” del tumore, impedendo così le recidive e le metastasi, che sono le sfide cliniche maggiori nel trattamento del cancro al polmone. Esistono già degli antagonisti di SIGMAR1 (come S1RA o NE100) sviluppati per altre indicazioni, che potrebbero essere testati in questo contesto.
La Strada è Ancora Lunga, Ma Promettente
Ovviamente, come in ogni ricerca scientifica seria, dobbiamo essere cauti. Questo è un primo passo importante, ma ci sono delle limitazioni. Abbiamo usato un modello *in vitro* (le tumorsfere A549) e sarà fondamentale confermare questi risultati usando altri modelli, magari isolando le CST con metodi diversi o utilizzando cellule derivate direttamente da biopsie di pazienti. Inoltre, abbiamo usato un silenziamento genico transitorio (siRNA); studi futuri dovranno usare tecniche per un blocco più stabile di SIGMAR1 (come CRISPR/Cas9 o shRNA).
Ma la limitazione più importante è che non abbiamo ancora dati *in vivo*, cioè in modelli animali. Sarà cruciale verificare se il blocco di SIGMAR1 riduce la capacità delle cellule tumorali polmonari di formare tumori e metastasi in topi immunodeficienti. Solo questi esperimenti potranno confermare se SIGMAR1 è davvero un “tallone d’Achille” delle CST polmonari in un contesto fisiologico complesso.
Infine, resta da capire *come* esattamente SIGMAR1 regola la staminalità. Sappiamo che questa proteina si trova in una zona particolare della cellula (le membrane associate ai mitocondri nel reticolo endoplasmatico) ed è coinvolta in molti processi cellulari (omeostasi del calcio, metabolismo lipidico, risposta allo stress del reticolo, autofagia). Quali di questi processi sono cruciali per il suo ruolo nelle CST? Svelare questi meccanismi sarà fondamentale per sviluppare terapie mirate ed efficaci.
In conclusione, anche se la strada è ancora lunga, la nostra ricerca suggerisce che SIGMAR1 è un attore importante nel mantenimento delle cellule staminali tumorali nel cancro al polmone. Tenere d’occhio SIGMAR1 potrebbe rivelarsi una strategia vincente per migliorare il trattamento di questa terribile malattia. Continueremo a indagare!
Fonte: Springer