SET-M33 e Impianti: Quando il Materiale Fa la Differenza Contro i Batteri!
Ciao a tutti! Oggi voglio parlarvi di una sfida che mi sta particolarmente a cuore e che riguarda un problema serio nel mondo medico: le infezioni legate agli impianti. Sapete, quando si inserisce un dispositivo medico nel corpo, come un pacemaker o una protesi, c’è sempre il rischio che qualche batterio birichino decida di fare festa proprio lì. E queste non sono infezioni qualsiasi, sono più subdole e difficili da trattare rispetto a quelle che colpiscono i tessuti senza un “corpo estraneo” di mezzo.
Il problema è che questi batteri possono formare una sorta di scudo, chiamato biofilm, sulla superficie dell’impianto, rendendo gli antibiotici tradizionali meno efficaci. Spesso, l’unica soluzione è rimuovere l’impianto, con tutto ciò che ne consegue per il paziente. Ecco perché la ricerca di nuove strategie per prevenire queste infezioni è fondamentale. E qui entra in gioco il protagonista della nostra storia: un peptide antimicrobico sintetico chiamato SET-M33.
Ma cos’è questo SET-M33 e perché è speciale?
Allora, i peptidi antimicrobici (AMP) sono delle molecole che la natura stessa ci offre: sono presenti in quasi tutti gli organismi viventi e rappresentano una prima linea di difesa contro batteri, virus e funghi. La cosa fantastica è che tendono a non generare facilmente resistenza batterica, un problema enorme con gli antibiotici classici. Il SET-M33 è un peptide sintetico, non naturale, progettato per imitare questi campioni della natura, ma con qualche asso nella manica. Ha una struttura particolare, detta tetrabranched (a quattro bracci, per capirci), che lo rende più stabile e più bravo a interagire con le membrane dei batteri, bucandole e mandandoli KO. Pensate che ha dimostrato di essere efficace contro un’ampia gamma di batteri e persino contro i biofilm!
La mia curiosità, e quella del team con cui ho lavorato, era capire come questo peptide interagisse con i materiali comunemente usati per gli impianti cardiaci (i cosiddetti CIED, Cardiac Implantable Electronic Devices) e per quelle “buste” protettive che a volte li avvolgono. Perché, vedete, le proprietà fisiche e chimiche di un materiale possono cambiare completamente le carte in tavola.
L’indagine: materiali sotto la lente e test di efficacia
Ci siamo concentrati su due gruppi di materiali. Da un lato, quelli che costituiscono l’impianto vero e proprio: la lega di titanio (Ti) per l’involucro della batteria e la gomma siliconica (Si) per la testa della batteria e il rivestimento dei cateteri. Come controllo, abbiamo aggiunto il politetrafluoroetilene (PTFE), famoso per essere antiaderente. Dall’altro lato, abbiamo esaminato materiali usati per le “buste” protettive: una membrana non riassorbibile di biocellulosa (BC) prodotta da batteri (sì, batteri che producono materiali utili!), una membrana riassorbibile elettrofilata di PLGA (Espn) e una rete riassorbibile di PGA (Mesh).
Per prima cosa, abbiamo analizzato la morfologia di questi materiali: la loro rugosità, la porosità, il diametro delle fibre (per quelli fibrosi) e quanto fossero “amici” dell’acqua (idrofilia). Poi, il test cruciale: abbiamo messo il SET-M33 (marcandolo con una sostanza fluorescente per seguirne il cammino) a contatto con le membrane porose per vedere come e quanto velocemente diffondesse attraverso di esse. E, ovviamente, abbiamo verificato l’efficacia antimicrobica del peptide combinato con ciascun materiale contro due brutti ceffi molto comuni nelle infezioni da impianto: Escherichia coli (un gram-negativo) e Staphylococcus aureus (un gram-positivo).
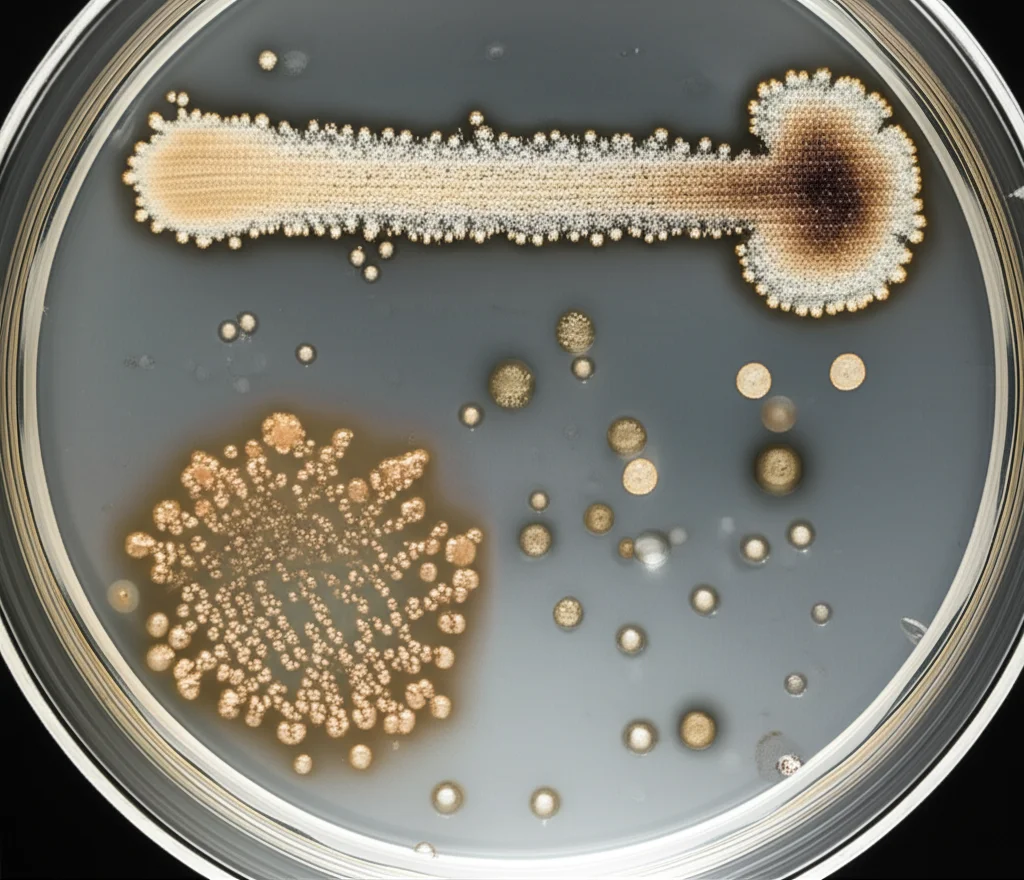
I risultati: non tutti i matrimoni funzionano!
E qui viene il bello! Abbiamo scoperto che i materiali porosi, come la biocellulosa (BC), le membrane elettrofilate (Espn) e le reti polimeriche (Mesh), in generale, facilitavano la diffusione del nostro SET-M33. La velocità di diffusione dipendeva proprio dalla loro architettura fibrosa intrinseca.
La biocellulosa (BC) si è rivelata una star: ha supportato egregiamente l’attività antimicrobica del peptide contro E. coli e S. aureus. Quando il peptide era applicato sullo stesso lato dei batteri (configurazione “cis”), l’inibizione della crescita era completa a tutte le concentrazioni testate! Tuttavia, la BC ha anche un “difetto”: la sua bassa porosità, pur essendo ottima per trattenere il farmaco, ne diminuiva la diffusione e quindi la disponibilità del peptide se i batteri si trovavano dall’altro lato della membrana (configurazione “trans”). In pratica, una buona parte del peptide (circa il 56%) rimaneva intrappolata nella membrana. Questo significa che, sebbene la BC possa eradicare i batteri a contatto diretto, potrebbe non essere altrettanto efficace nel proteggere zone più distanti.
L’efficacia del SET-M33, invece, era ridotta quando combinato con le altre membrane porose testate (Espn e Mesh) e con le interfacce non porose degli impianti CIED, come il titanio e il silicone. Su titanio e PTFE, il peptide non ha mostrato effetti significativi contro E. coli. Sul silicone, si è vista una riduzione della crescita batterica solo a concentrazioni più alte del peptide. Contro S. aureus, purtroppo, nessun effetto antimicrobico rilevabile su titanio, silicone o PTFE con SET-M33. Anche le membrane Espn e Mesh trattate con SET-M33 non hanno avuto un impatto significativo sulla crescita di S. aureus.
Un dato interessante è che il trattamento con SET-M33 aumentava l’idrofilia superficiale di tutti i materiali. E, cosa importantissima, né i materiali da soli né la loro combinazione con SET-M33 hanno mostrato citotossicità, il che è un’ottima notizia per la biocompatibilità.
Cosa ci dice tutto questo per il futuro?
Questi risultati sono fondamentali. Ci dicono che non basta avere un peptide antimicrobico potente; bisogna scegliere con cura il “partner”, cioè il materiale dell’impianto o dell’involucro protettivo. Le proprietà del materiale, come la porosità e la morfologia superficiale, sono cruciali nel modulare l’efficacia del peptide.
Le attuali “buste” antibiotiche usate per i CIED funzionano rilasciando antibiotici classici per alcuni giorni, e hanno dimostrato di ridurre le infezioni. Ma il fantasma dell’antibiotico-resistenza è sempre in agguato. I peptidi antimicrobici come il SET-M33 potrebbero offrire una soluzione più sostenibile, magari garantendo una copertura a lungo termine, anche per settimane dopo l’impianto.
Certo, la strada non è semplice. Rivestire direttamente materiali come il titanio e il silicone con SET-M33 non sembra essere sufficiente, data la loro natura non porosa e liscia, pensata per limitare l’adesione. Modificare questi materiali per facilitare l’adesione del peptide potrebbe comprometterne la funzionalità. Forse la soluzione starà nell’ingegnerizzare chimicamente il peptide stesso, aggiungendo “ganci” specifici per legarsi alla superficie dell’impianto senza perdere attività.
Per quanto riguarda gli involucri protettivi, c’è più flessibilità. Materiali con pori macroscopici, come le reti (Mesh), permettono una diffusione rapida, ma nel nostro caso non hanno supportato l’attività del SET-M33. La biocellulosa (BC), invece, ha un’alta capacità di caricamento e ha mostrato un’ottima azione antimicrobica a contatto, ma la sua elevata ritenzione del farmaco è un fattore da considerare. Se la BC è pensata per rimanere lì a lungo come barriera fisica (impedisce ai batteri di passare!), il peptide intrappolato potrebbe non contribuire all’effetto antimicrobico a distanza. Per materiali riassorbibili come Espn e Mesh, anche se una piccola frazione di peptide viene trattenuta, il processo di degradazione del materiale nel tempo potrebbe portare a un rilascio graduale e sostenuto del peptide, come già avviene per alcuni prodotti commercializzati.

La strada è tracciata, ma la ricerca continua!
Insomma, il SET-M33 è promettente, ma per tradurlo in soluzioni “pronte all’uso” per proteggere le tasche chirurgiche degli impianti permanenti, serviranno configurazioni peptidiche dedicate e ottimizzate. Bisogna trovare il giusto equilibrio tra diffusione, ritenzione ed efficacia antimicrobica, tenendo conto del complesso ambiente della tasca chirurgica.
Il mio lavoro e quello dei miei colleghi getta le basi per lo sviluppo di farmaci antimicrobici di nuova generazione. L’obiettivo è ambizioso: offrire alternative agli antibiotici che possano eguagliare, e magari superare, l’efficacia delle attuali buste antibiotiche, fornendo una soluzione più duratura e libera dal rischio di resistenze per prevenire le infezioni nel campo degli impianti. La sfida è aperta, e io sono entusiasta di farne parte!
Fonte: Springer