Glioblastoma e Senescenza: Un Inganno Cellulare Svelato! Come p21 Mette i Freni (Ma Non Tutti)
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante nel cuore di una delle sfide più ardue della medicina moderna: il glioblastoma, un tumore cerebrale particolarmente aggressivo. Parleremo di un fenomeno chiamato senescenza indotta dalla terapia (TIS). Immaginate le cellule tumorali che, invece di morire sotto l’attacco dei farmaci, decidono di “andare in pensione”: smettono di dividersi, diventano vecchie, senescenti appunto. Sembrerebbe una buona notizia, no? Beh, non è così semplice. Queste cellule “pensionate” possono creare un sacco di problemi, come infiammazione e, potenzialmente, essere la causa di future recidive. Capire come si innesca questa senescenza è cruciale per trovare modi per contrastarla o sfruttarla a nostro vantaggio.
La Scena del Crimine: Il Glioblastoma e il Farmaco TMZ
Il nostro “caso” inizia con il temozolomide (TMZ), un farmaco chemioterapico usato in prima linea contro il glioblastoma. Studi precedenti, inclusi alcuni a cui ho avuto il piacere di contribuire indirettamente seguendo la letteratura, hanno mostrato che il TMZ, danneggiando il DNA delle cellule tumorali (in particolare creando una lesione chiamata O6-metilguanina), scatena una risposta al danno che porta principalmente alla senescenza, più che alla morte cellulare diretta (apoptosi). Questa risposta coinvolge una cascata di segnali molecolari (la via ATR/ATM-CHK1/CHK2-p53, per i più tecnici). Ma cosa succede *dopo* questa attivazione iniziale? Quali ingranaggi molecolari portano effettivamente la cellula a fermarsi e diventare senescente? Questo è il mistero che abbiamo cercato di svelare.
Il Solito Sospettato: Il Complesso DREAM è Innocente?
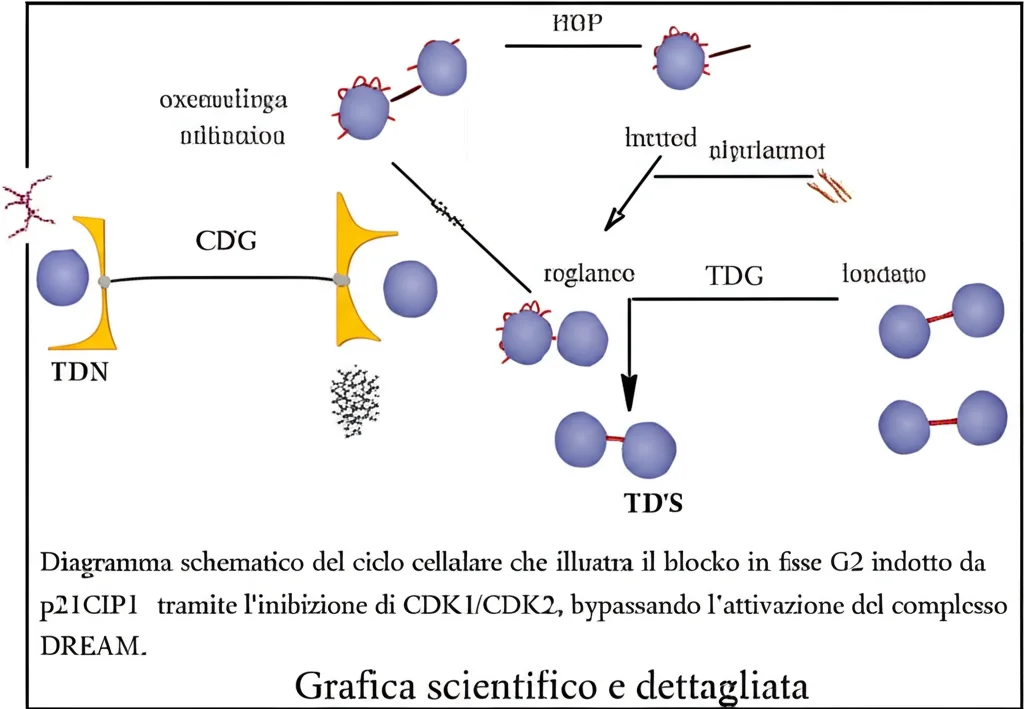
Nel mondo della biologia cellulare, quando si parla di arresto del ciclo cellulare e senescenza, un nome salta spesso fuori: il complesso DREAM. Questo complesso proteico agisce come un potente freno, bloccando l’espressione di geni necessari per la proliferazione cellulare e mantenendo le cellule in uno stato di quiescenza (fase G0). Spesso, la proteina p21CIP1 (un noto “guardiano” del ciclo cellulare, indotto dal famoso p53) attiva DREAM inibendo un’altra proteina, CDK4. Quindi, la logica suggerirebbe: TMZ danneggia il DNA -> p53 si attiva -> p21 viene prodotto -> p21 inibisce CDK4 -> DREAM si attiva -> la cellula diventa senescente. Semplice, no?
E invece no! Qui arriva la sorpresa. Analizzando cellule di glioblastoma (in particolare la linea LN229) trattate con TMZ, abbiamo scoperto che, sebbene p21CIP1 fosse fortemente indotta, il complesso DREAM non veniva attivato come ci si aspettava! Abbiamo guardato i livelli di fosforilazione (un interruttore molecolare) di proteine chiave come RB e p130, che sono indicatori dell’attività di DREAM, e non abbiamo visto i cambiamenti tipici dell’attivazione. Un vero colpo di scena!

Il Vero Meccanismo: p21 Colpisce Altrove!
Se non è DREAM, allora chi è il responsabile? Le nostre indagini ci hanno portato a guardare più da vicino cosa stesse facendo p21. E abbiamo scoperto qualcosa di molto interessante: nelle cellule di glioblastoma trattate con TMZ, p21CIP1 non interagiva significativamente con CDK4 (il bersaglio per attivare DREAM), ma legava invece altre due chinasi ciclina-dipendenti: CDK1 e CDK2. Queste sono cruciali per la progressione attraverso la fase G2 del ciclo cellulare e l’ingresso in mitosi (la divisione cellulare vera e propria).
Inibendo CDK1 e CDK2, p21 bloccava efficacemente la segnalazione a valle mediata da altre due proteine, B-Myb e FOXM1, che sono essenziali per attivare i geni necessari alla divisione cellulare. Il risultato? Le cellule si arrestavano in fase G2. Questo arresto iniziale, in realtà, è innescato dalla risposta al danno al DNA (attivazione di CHK1/WEE1 e degradazione di CDC25c), ma è p21 che, legandosi a CDK1/2 più tardi, sembra rendere questo arresto più stabile e duraturo, portando alla senescenza. È importante notare che l’arresto iniziale in G2 avviene anche senza p21, ma la senescenza vera e propria, quella che si instaura dopo, dipende fortemente da p21.
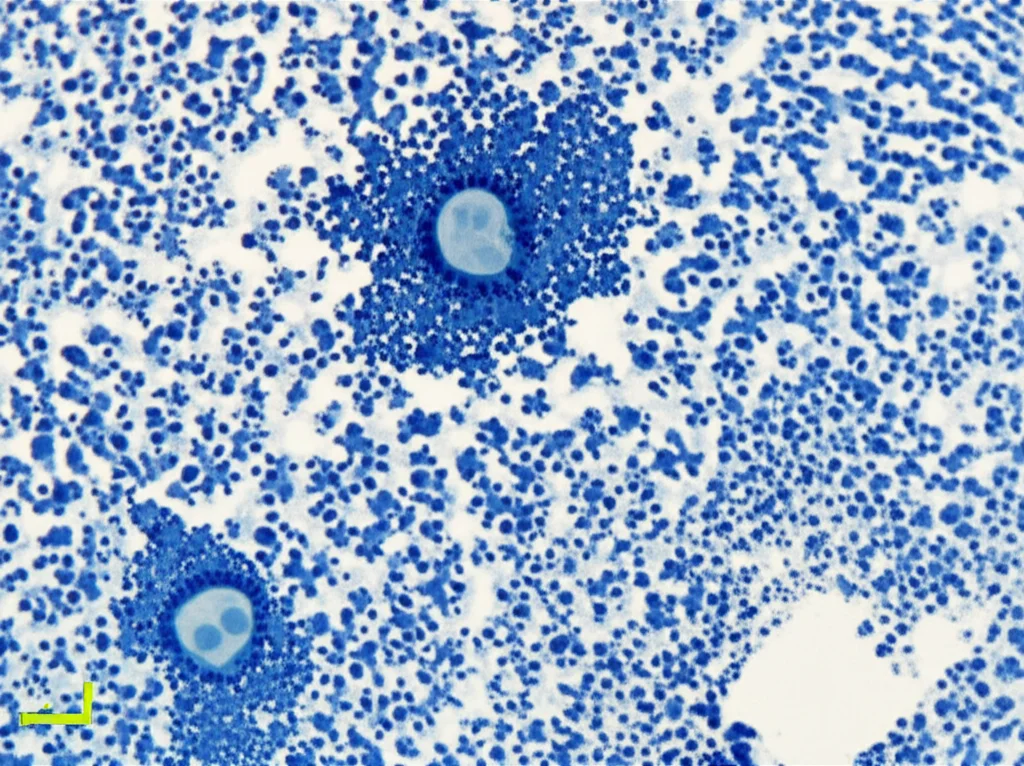
Il Problema dell’Arresto Incompleto: Nascono le Cellule Giganti!
Ma c’è un altro dettaglio cruciale. L’arresto in G2 indotto da questo meccanismo p21-CDK1/2, senza l’attivazione completa di DREAM, si è rivelato… incompleto. Cosa significa? Significa che, sebbene le cellule non potessero entrare in mitosi, riuscivano in qualche modo a “tornare indietro” e a riavviare la sintesi del DNA (la fase S), senza però essersi divise. Questo processo si chiama endoreduplicazione. Immaginate una fotocopiatrice che continua a fare copie del documento originale senza mai separare i fogli. Il risultato è una cellula con un contenuto di DNA doppio (4n), quadruplo (8n) o anche maggiore, diventando enorme: una cellula gigante poliploide.
Questo fenomeno spiega l’aspetto caratteristico delle cellule senescenti indotte da TMZ nel glioblastoma: grandi, piatte e con nuclei multipli o molto grandi. La mancata attivazione di DREAM, in particolare la mancata repressione di geni importanti per la transizione G1/S (come E2F1, che infatti abbiamo visto rimanere attivo o addirittura aumentare), sembra permettere questo “scivolamento” indietro verso la sintesi del DNA.
Implicazioni Terapeutiche: Possiamo Sfruttare Questa Conoscenza?
Questa scoperta non è solo una curiosità biologica, ma apre scenari terapeutici interessanti.
- Le cellule giganti sono un problema? Si sospetta che queste cellule poliploidi possano essere più resistenti ai farmaci o avere una maggiore capacità di sfuggire alla senescenza e tornare a proliferare, contribuendo alle recidive.
- Possiamo prevenire la formazione di cellule giganti? Abbiamo provato a usare un farmaco chiamato palbociclib, un inibitore di CDK4/6 (anche se CDK4 non sembrava direttamente coinvolto nel legame con p21 qui, ha altri ruoli nel ciclo cellulare). Aggiungendo palbociclib dopo il trattamento con TMZ, quando le cellule erano già arrestate in G2 ma non ancora diventate poliploidi, abbiamo visto che l’endoreduplicazione veniva drasticamente ridotta! Il palbociclib sembrava stabilizzare l’arresto in G2, probabilmente inibendo quella residua attività pro-proliferativa (come quella di E2F1) che permetteva la ri-sintesi del DNA. Questo suggerisce che combinare TMZ con inibitori di CDK4/6 potrebbe rendere la senescenza più “stabile” e meno incline a generare queste cellule potenzialmente problematiche.
- E la riparazione del DNA? Un’altra caratteristica spesso associata alla senescenza mediata da DREAM è la ridotta capacità di riparare il DNA. Noi avevamo osservato in passato che, subito dopo il trattamento con TMZ, alcuni geni di riparazione (come MSH2, MSH6, EXO1) venivano effettivamente repressi. Tuttavia, con nostra sorpresa, abbiamo visto che nelle cellule ormai stabilmente senescenti (dopo 144 ore), l’espressione di questi geni tornava a livelli normali! Questo si spiega perfettamente con la mancata attivazione completa di DREAM: questi geni di riparazione sono spesso bersagli di DREAM regolati nella fase G1/S, fase che non viene efficacemente bloccata in questo contesto. Anche qui, l’aggiunta di palbociclib riusciva a mantenere bassi i livelli di questi geni. Questo recupero della capacità di riparazione potrebbe avere implicazioni sulla resistenza a lungo termine, anche se nei cloni cellulari che erano “sfuggiti” alla senescenza non abbiamo trovato una diretta correlazione con l’alterazione di questi geni specifici.
Un Meccanismo Specifico del Glioblastoma?
Abbiamo verificato se questo comportamento fosse comune ad altre linee cellulari di glioblastoma (A172, U87MG) e abbiamo ottenuto risultati simili: induzione di p21, legame a CDK1/2 ma non a CDK4, arresto in G2, endoreduplicazione e mancata attivazione completa di DREAM. Abbiamo anche confermato alcuni di questi aspetti in vivo, in modelli animali (xenotrapianti).
Ma è un fenomeno universale? Abbiamo confrontato la risposta del glioblastoma con quella di cellule di cancro al seno (MCF7) e cellule epiteliali non tumorali (RPE1) trattate con TMZ o altri farmaci chemioterapici (irinotecan, oxaliplatin). Ebbene, in queste altre cellule, la senescenza indotta dalla terapia sembrava seguire il percorso “classico”, con l’attivazione di DREAM e la repressione dei suoi geni bersaglio, senza la massiccia endoreduplicazione vista nel glioblastoma. Questo suggerisce che il meccanismo p21-CDK1/2 senza DREAM potrebbe essere una caratteristica specifica delle cellule di glioblastoma in risposta a questo tipo di danno al DNA.

Conclusioni e Prospettive Future
Quindi, cosa abbiamo imparato? Che la senescenza indotta da TMZ nel glioblastoma segue una strada inaspettata: non si affida al classico freno DREAM, ma utilizza p21CIP1 per bloccare CDK1 e CDK2, inducendo un arresto in G2. Questo arresto, però, è “permeabile” e permette alle cellule di diventare giganti poliploidi attraverso l’endoreduplicazione.
Questo ci dice che non possiamo dare per scontati i meccanismi cellulari, nemmeno quelli che sembrano ben stabiliti! Ogni tipo di cancro, ogni contesto, può nascondere delle sorprese. La scoperta che gli inibitori di CDK4/6 come il palbociclib possono prevenire la formazione di queste cellule giganti e stabilizzare la senescenza è particolarmente promettente e potrebbe aprire la strada a nuove strategie terapeutiche combinate per il glioblastoma.
Certo, restano domande aperte: perché p21 non interagisce con CDK4 in queste cellule? Qual è il destino a lungo termine delle cellule senescenti stabilizzate con palbociclib? La ricerca continua, ma ogni passo avanti nella comprensione di questi meccanismi complessi ci avvicina un po’ di più a terapie più efficaci contro questo terribile tumore. Spero che questo tuffo nella biologia cellulare del cancro vi abbia incuriosito!
Fonte: Springer