Tumori Neuroendocrini Metastatici: Sveliamo i Segreti del Loro DNA e RNA per Nuove Cure!
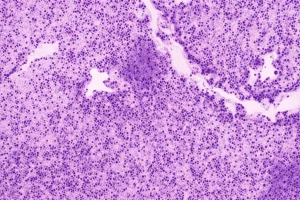
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante nel mondo un po’ misterioso dei tumori neuroendocrini, o NEN come li chiamiamo tra addetti ai lavori. Si tratta di un gruppo di neoplasie davvero eterogeneo, che possono presentarsi in diverse parti del corpo e avere prognosi molto variabili. Capire a fondo questi tumori è una sfida, ma grazie alle meraviglie della genomica e della trascrittomica, stiamo facendo passi da gigante!
Recentemente, insieme al mio team, ci siamo immersi nello studio di 28 casi di NEN metastatici. Lo so, 28 potrebbero sembrare pochi, ma ogni singolo caso è una miniera d’oro di informazioni, specialmente quando si tratta di tumori rari o poco studiati in fase metastatica. Il nostro obiettivo? Capire meglio le loro caratteristiche molecolari, sia a livello di DNA (genomica) che di RNA (trascrittomica), per vedere se ci sono somiglianze o differenze cruciali a seconda del sito primario del tumore e, soprattutto, come queste informazioni possano aiutarci nella pratica clinica.
Ma cosa sono esattamente questi NEN?
I tumori neuroendocrini nascono dalle cellule neuroendocrine, che sono un po’ speciali: hanno caratteristiche sia delle cellule endocrine (quelle che producono ormoni) sia delle cellule nervose. Si trovano sparse in quasi tutti i tessuti del nostro corpo. Per classificarli e decidere le terapie, di solito guardiamo a cose come la differenziazione istologica (quanto le cellule tumorali assomigliano a quelle sane) e gli indici di proliferazione (quanto velocemente si dividono). Questo ci porta a una prima grande distinzione:
- Tumori neuroendocrini ben differenziati (NET): ulteriormente classificati in gradi da 1 a 3 (G1-G3) a seconda della velocità di crescita.
- Carcinomi neuroendocrini scarsamente differenziati (NEC): che possono essere a piccole cellule o a grandi cellule.
La maggior parte degli studi finora si è concentrata sui tumori primari, quelli nel sito d’origine. Noi, invece, abbiamo voluto guardare alle metastasi, cioè quando il tumore si è già diffuso, perché è qui che la battaglia si fa più dura e le opzioni terapeutiche standard sono spesso limitate. E abbiamo incluso anche un caso di MiNEN (neoplasia mista neuroendocrina-non neuroendocrina), una vera rarità!
Il nostro approccio: un’analisi a 360 gradi con WGTA
Per questa avventura scientifica, abbiamo utilizzato una tecnica potentissima chiamata Whole Genome and Transcriptome Analysis (WGTA), grazie al programma Personalized OncoGenomics (POG) del BC Cancer. In pratica, abbiamo “letto” l’intero genoma (DNA) e l’intero trascrittoma (l’insieme di tutte le molecole di RNA) delle cellule tumorali dei nostri pazienti. Questo ci dà una visione incredibilmente dettagliata di cosa sta succedendo a livello molecolare.
I pazienti inclusi nel nostro studio avevano tutti malattia metastatica e avevano già ricevuto uno o più trattamenti. I campioni provenivano da otto diversi siti anatomici primari, oltre a un NEN di origine sconosciuta e un MiNEN ovarico. Una bella varietà, insomma!
Cosa abbiamo scoperto? Le sorprese del genoma e del trascrittoma
Analizzando i dati, abbiamo trovato alcune cose davvero interessanti. Ad esempio, mutazioni ricorrenti in geni come MEN1, DAXX, RB1 e TP53 erano presenti nei NEN pancreatici (PanNEN) e polmonari (PulNEN), mentre mutazioni attivanti di RET erano tipiche dei carcinomi midollari della tiroide (MTC). Questo conferma scoperte precedenti, ma è importante vederlo anche nei tumori metastatici.
Una cosa curiosa: la maggior parte dei PanNEN con mutazione di MEN1 mostrava una perdita su larga scala di eterozigosi (LOH), un fenomeno genetico particolare, mentre i PulNEN con la stessa mutazione di MEN1 no. Questo suggerisce che, anche con alterazioni genetiche simili, il “contesto” del tumore primario conta.
Il carico mutazionale tumorale (TMB), cioè il numero di mutazioni per megabase di DNA, era mediamente di 2.19 mut/mb. Non altissimo, ma con due casi che superavano le dieci mutazioni. L’aneuploidia (un numero anomalo di cromosomi) era comune, indipendentemente dal sito primario. Abbiamo anche notato amplificazioni di geni importanti come MYC o MYCN in un NEN ovarico e uno pancreatico.
Le “firme mutazionali”, cioè i pattern specifici di mutazioni, ci hanno raccontato altre storie. Abbiamo visto contributi significativi dalla famiglia di enzimi APOBEC e da deficit nella riparazione del DNA (dMMR). Un paziente, ad esempio, aveva una forte firma dMMR a causa di una perdita biallelica germinale di NTHL1 (una storia che avevamo già raccontato!). Un altro, che aveva ricevuto terapia con platino per quasi un anno, mostrava firme mutazionali associate proprio a quel trattamento. Questo ci dice che anche le terapie precedenti lasciano un’impronta sul genoma del tumore.
I tre “club” dei NEN metastatici: i cluster A, B e C
Quando abbiamo analizzato i profili trascrittomici (cioè l’espressione dei geni), abbiamo fatto una scoperta entusiasmante: i nostri 28 NEN si sono raggruppati spontaneamente in tre gruppi distinti, che abbiamo chiamato Cluster A, B e C.
- Il Cluster A conteneva la maggior parte dei NET del piccolo intestino e dei PanNET. Qui abbiamo trovato quasi tutti i casi di PanNEN con mutazioni in MEN1 e tutti quelli con mutazioni in DAXX e/o ATRX.
- Il Cluster C era composto principalmente da PulNET e MTC.
- Il Cluster B era il più eterogeneo, con NEN da vari siti primari, ma generalmente caratterizzati da un alto grado (Ki67 > 20%) e/o da istologia scarsamente differenziata o mista.
La cosa interessante è che sette NEN appartenenti ai Cluster A o C erano in realtà NEC o NET-G3, cioè tumori considerati più aggressivi. Questo suggerisce che, a livello di trascrittoma, alcuni tumori ad alto grado possono assomigliare a quelli a basso grado in un contesto metastatico.
Confrontando i nostri dati con altri dataset pubblici (come The Cancer Genome Atlas, TCGA), abbiamo visto che l’82% dei nostri NEN metastatici formava un gruppo distinto, vicino ad altri NEN ma separato da altri tipi di tumore. Questo è fondamentale: nonostante la loro eterogeneità e la variabilità dovuta al sito primario, i NEN metastatici sembrano avere un’identità molecolare comune che li distingue da altri cancri. Sono più simili tra loro che ad altri tipi di tumore!
Tuttavia, i NEN del Cluster B a volte facevano eccezione, raggruppandosi in base al loro sito primario o addirittura con tipi di tumore non correlati. Ad esempio, il MiNEN ovarico PN19, un campione ad alto grado con amplificazione di MYC, si è raggruppato con gli adenocarcinomi colorettali del TCGA. L’analisi dei pathway ha confermato un’attivazione dei target di MYC nel Cluster B, suggerendo che questi tumori potrebbero essere più aggressivi.
Implicazioni cliniche: verso una medicina personalizzata
Ma a cosa serve tutta questa conoscenza? Beh, qui arriva la parte più entusiasmante per i pazienti! L’analisi WGTA ci ha permesso di identificare alterazioni potenzialmente “azionabili” clinicamente in ben 24 pazienti. Queste potevano essere piccole mutazioni, alterazioni del numero di copie dei geni, varianti strutturali, espressione genica anomala o firme genomiche particolari.
Di questi, 15 pazienti hanno ricevuto trattamenti standard che erano però supportati dalle scoperte della WGTA. E la cosa straordinaria è che 10 di loro hanno avuto un beneficio clinico, definito come malattia stabile o risposta parziale, che si è associato anche a un tempo più lungo in trattamento. Spesso, le decisioni terapeutiche sono state guidate dai dati di espressione genica (trascrittoma), dalle mutazioni (genoma) o da entrambi.

Questo è un punto cruciale: la diagnosi e il trattamento dei NEN, specialmente metastatici, sono una vera sfida. Il nostro studio, seppur su una piccola coorte, mostra come la caratterizzazione molecolare approfondita possa non solo farci capire meglio questi tumori, ma anche identificare nuove strategie terapeutiche. E c’è un bisogno disperato di nuove opzioni!
Un occhio di riguardo per i casi rari: il MiNEN ovarico
L’analisi WGTA ci permette anche di studiare tumori rarissimi, come il MiNEN ovarico del paziente PN19. Questi tumori sono così rari che la loro caratterizzazione molecolare completa è quasi inesistente. Nel caso di PN19, abbiamo trovato una mutazione attivante di KRAS, mutazioni con perdita di funzione in TP53, RB1, SMAD4, e l’amplificazione di diversi oncogeni, tra cui MYC, CDK8 e FLT1. I NEN guidati da MYC sono noti per essere molto aggressivi e resistenti ai trattamenti, e purtroppo PN19 aveva una malattia refrattaria ed è venuto a mancare poco dopo la biopsia. Il fatto che questo MiNEN (composto per il 60% da adenocarcinoma e per il 40% da componente neuroendocrina) si sia raggruppato con i tumori colorettali del TCGA potrebbe riflettere la sua componente istologica dominante o forse firme genomiche condivise dovute a trattamenti simili, data la presenza di firme mutazionali associate a precedente terapia con platino.
Limiti e prospettive future
Certo, il nostro studio ha dei limiti, come la piccola dimensione della coorte e l’impossibilità di confrontare i campioni con quelli pre-trattamento (dato che il programma POG si concentra su tumori avanzati/metastatici). Nonostante ciò, le alterazioni genomiche che abbiamo identificato sono in gran parte coerenti con studi precedenti su NEN primari e metastatici.
L’inclusione dei dati trascrittomici ci ha permesso di ottenere intuizioni molecolari sulle caratteristiche biologiche condivise e distinte di questi tumori rari, evidenziando la loro complessità molecolare. Anche se c’è una notevole variabilità genomica e trascrittomica nei NEN metastatici provenienti dallo stesso sito primario, abbiamo scoperto che la maggioranza dei NEN è comunque più simile tra loro che ad altri tipi di cancro.
Serviranno studi su coorti più ampie, ma il nostro lavoro sottolinea il potenziale enorme che la WGTA ha nella pratica clinica. Potrebbe aiutare i medici a scegliere come sequenziare le terapie, una delle sfide maggiori nel trattamento dei NEN. Pensate, l’analisi del trascrittoma da sola ha informato trattamenti standard che hanno portato beneficio clinico a sei pazienti! Questo conferma che i dati di espressione genica sono altrettanto informativi nell’identificare potenziali bersagli terapeutici.
In conclusione, abbiamo fatto un bel passo avanti nella comprensione dei paesaggi genomici e trascrittomici dei NEN metastatici. È un campo di ricerca in continua evoluzione, e ogni nuova scoperta ci avvicina un po’ di più a trattamenti più efficaci e personalizzati per i pazienti che affrontano questa complessa malattia. La strada è ancora lunga, ma la speranza è tanta!

Fonte: Springer