Fibrosi Polmonare: Ho Ascoltato i Sussurri Nascosti tra le Cellule!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante nel microscopico mondo dei nostri polmoni, un luogo dove si combatte una battaglia silenziosa ma devastante: la fibrosi polmonare idiopatica (FPI). Immaginate il tessuto polmonare, normalmente soffice ed elastico come una spugna, che inizia a indurirsi, a cicatrizzarsi, rendendo sempre più faticoso il semplice atto di respirare. Questa è la FPI, una malattia cronica, progressiva e, purtroppo, spesso fatale, la cui causa rimane ancora un mistero.
La diagnosi precoce è fondamentale, ma è una vera sfida. Spesso, quando compaiono sintomi come tosse secca e persistente o difficoltà respiratorie, la malattia è già in uno stadio avanzato. Le tecniche attuali, come la TAC ad alta risoluzione (HRCT) o la biopsia polmonare, hanno i loro limiti: richiedono strumenti precisi, operatori esperti e, nel caso della biopsia, sono invasive. Ecco perché la ricerca di biomarcatori, segnali specifici della malattia rintracciabili in modo meno invasivo, è così cruciale.
Dove Cercare Nuovi Indizi? Nel Liquido Interstiziale!
Qui entra in gioco la nostra idea un po’ fuori dagli schemi: e se la chiave per capire la progressione della fibrosi non fosse solo nelle cellule stesse, ma nello spazio *tra* di esse? Parlo del liquido interstiziale, quel fluido che avvolge le cellule nei tessuti, una sorta de “brodo primordiale” locale ricco di proteine secrete, escrete o rilasciate dalle cellule circostanti. Rispetto al sangue, che è un “calderone” di segnali provenienti da tutto il corpo, il liquido interstiziale del polmone è molto più vicino all’azione, al cuore del problema. Potrebbe contenere proteine “spia” molto specifiche della fibrosi, meno “inquinate” da segnali provenienti da altri organi.
Affascinante, vero? Così, abbiamo deciso di indagare. Abbiamo usato un modello animale, topolini C57/BL6N, a cui abbiamo indotto la fibrosi polmonare usando la bleomicina, una sostanza nota per causare questo tipo di danno. Abbiamo seguito questi topolini nel tempo, osservando come la malattia progrediva a 7, 14, 21 e 28 giorni dall’induzione.
Osservare la Progressione: Dalla Funzione Respiratoria alla Proteomica
Prima di tutto, dovevamo essere sicuri che il nostro modello funzionasse e capire come la malattia evolvesse. Abbiamo usato diverse tecniche:
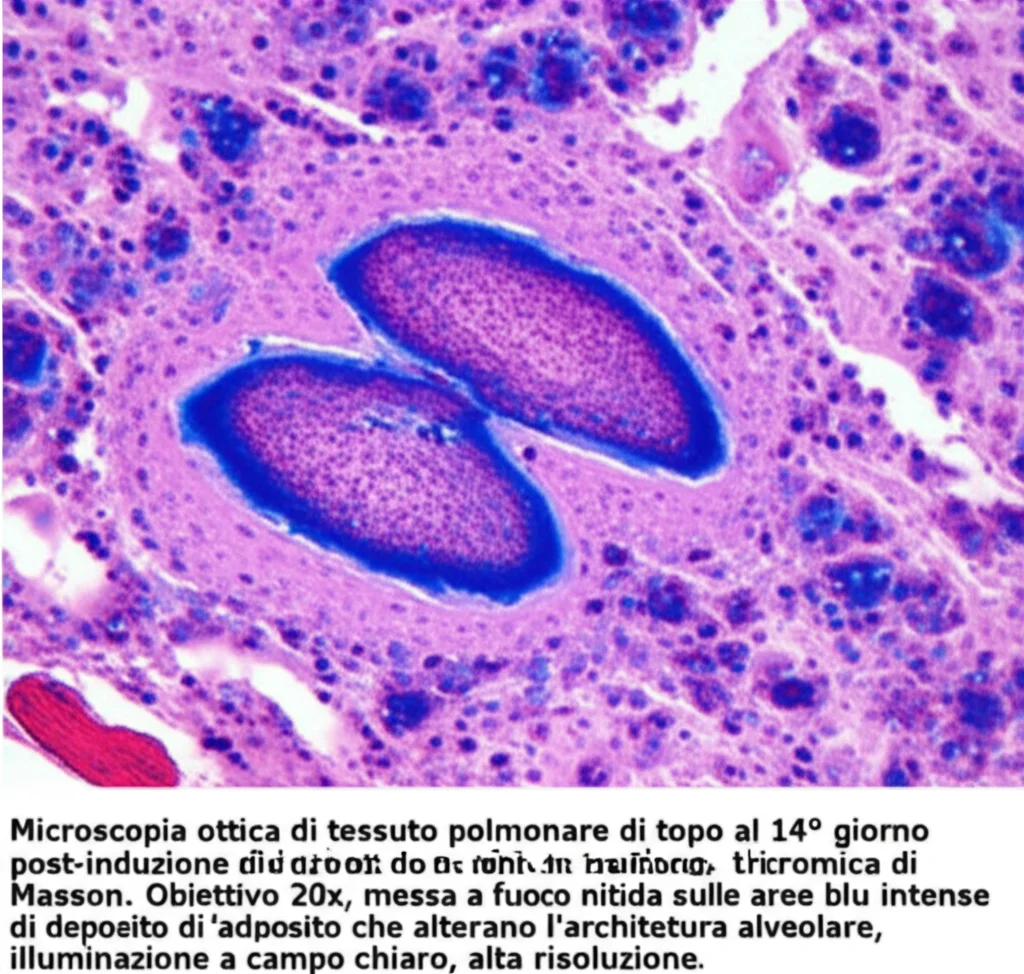
- Colorazioni istologiche (Ematossilina-Eosina e Tricromica di Masson): Per vedere al microscopio come cambiava la struttura del tessuto polmonare, l’infiammazione e l’accumulo di collagene (la “cicatrice”).
- TAC ad alta risoluzione (HRCT): Proprio come negli umani, per visualizzare le lesioni fibrotiche nei polmoni dei topolini.
- Test di funzionalità polmonare: Per misurare parametri come il volume corrente (quanto aria entra ed esce ad ogni respiro) e la frequenza respiratoria.
I risultati sono stati chiari: rispetto ai topolini sani, quelli con fibrosi mostravano una riduzione dell’area degli alveoli, un aumento del deposito di collagene, una diminuzione del volume corrente e un aumento della frequenza respiratoria. Il picco del danno sembrava verificarsi intorno al 14° giorno. Le immagini TAC mostravano le tipiche ombre reticolari e a “nido d’ape” della fibrosi.
A questo punto, è arrivato il momento clou: l’analisi del liquido interstiziale. Abbiamo estratto con cura questo fluido dai polmoni dei diversi gruppi di topi (sani e fibrotici a vari stadi) e abbiamo utilizzato una tecnica potentissima chiamata proteomica DIA (Data-Independent Acquisition). In pratica, è come fare un inventario super dettagliato di tutte le proteine presenti nel liquido e, soprattutto, misurare *quanto* ce n’è di ciascuna. L’obiettivo? Trovare le proteine la cui quantità cambiava significativamente durante la progressione della fibrosi.
I Segreti Rivelati dalle Proteine: Un Racconto a Tappe
Analizzando migliaia di proteine (ne abbiamo identificate ben 4666!), abbiamo scoperto che il profilo proteico del liquido interstiziale cambiava drasticamente nelle diverse fasi della malattia. Usando analisi bioinformatiche come l’arricchimento funzionale GO (Gene Ontology) e KEGG (Kyoto Encyclopedia of Genes and Genomes), abbiamo potuto associare questi cambiamenti a specifici processi biologici.
Fase Iniziale (Giorno 7): Caos Energetico e Segnali di Calcio
Nei primi giorni dopo l’induzione della fibrosi (giorno 7), abbiamo visto cambiamenti importanti in proteine legate a:
- Metabolismo energetico: Alterazioni nel metabolismo del glucosio, nel trasporto dei lipidi, nel metabolismo delle glicoproteine e nella sintesi di composti solforati. Sembra che le cellule polmonari entrino in una sorta di “crisi energetica” iniziale.
- Trasporto di ioni calcio: Modifiche nelle proteine che gestiscono il calcio all’interno e all’esterno delle cellule. Il calcio è un messaggero cellulare fondamentale, e alterazioni nel suo equilibrio possono innescare molte risposte, inclusa l’infiammazione.
Questi risultati suggeriscono che l’infiammazione acuta e le prime fasi della fibrosi sono accompagnate da un profondo sconvolgimento metabolico e della segnalazione cellulare.
Fase di Picco (Giorno 14): Lo Stress del Reticolo Endoplasmatico
Al 14° giorno, quando il danno polmonare era al suo massimo, il protagonista assoluto è diventato lo stress del reticolo endoplasmatico (RE). Il RE è come la “fabbrica di assemblaggio” delle proteine nella cellula. Quando è sovraccarico o danneggiato (stressato, appunto), la produzione e il ripiegamento corretto delle proteine vanno in tilt. Abbiamo trovato un arricchimento significativo di proteine legate a:
- Ripiegamento proteico (Protein folding): Incluse le proteine dello shock termico (Heat Shock Proteins, HSPs), come la HSP60.
- Trasporto di vescicole tra RE e Golgi.
- Vie di segnalazione dello stress del RE.
Questo stress del RE sembra essere un meccanismo chiave in questa fase critica. Può portare alla morte delle cellule epiteliali alveolari (quelle che rivestono gli alveoli) e, cosa cruciale, può attivare i fibroblasti, trasformandoli in miofibroblasti, le cellule “operaie” che producono eccessivamente collagene e causano la cicatrizzazione. Abbiamo anche confermato con esperimenti di Western Blot l’aumento di proteine chiave legate a questa via, come CHOP (una proteina marker dello stress del RE che può indurre apoptosi) e α-SMA (Alpha smooth muscle actin, un marker dei miofibroblasti attivati), insieme a una diminuzione di HSP60 in questa fase specifica secondo l’analisi proteomica (anche se il Western Blot mostra un pattern diverso che richiede approfondimento, forse legato a diversi pool proteici o tempi).
Fase Tardiva (Giorni 21 e 28): Rimodellamento della Matrice e Segnali Meccanici
Nelle fasi più avanzate (giorni 21 e 28), quando il tessuto tenta forse una sorta di “stabilizzazione” o rimodellamento cronico, sono emerse altre vie:
- Interazione Recettore-Matrice Extracellulare (ECM): Cambiamenti nelle proteine che mediano il dialogo tra le cellule e la “impalcatura” che le circonda (la matrice extracellulare, ormai ricca di collagene).
- Stress da Scorrimento Fluido (Fluid Shear Stress): Segnali legati alle forze meccaniche esercitate dal flusso sanguigno nei piccoli vasi, che possono influenzare il comportamento cellulare nel contesto fibrotico.
- Metabolismo: Continuavano ad esserci alterazioni in vie metaboliche specifiche (es. metabolismo dei pentosi e dell’acido glucuronico, degradazione della lisina).
Questo suggerisce che nella fase cronica, la comunicazione tra le cellule e la matrice alterata, insieme alle forze meccaniche, gioca un ruolo importante nel mantenere o modulare il processo fibrotico.
Cosa Ci Dice Tutto Questo? Implicazioni e Speranze Future
Questa analisi dettagliata del liquido interstiziale polmonare ci ha permesso di “ascoltare” la storia della fibrosi polmonare nel nostro modello animale, tappa dopo tappa. Abbiamo visto come diversi processi biologici dominano le varie fasi: dal caos metabolico iniziale, allo stress critico della “fabbrica” cellulare (RE) nella fase di picco, fino al complesso dialogo tra cellule, matrice e forze meccaniche nella fase cronica.
La scoperta più intrigante è forse il ruolo centrale dello stress del reticolo endoplasmatico nella fase acuta/estrema della fibrosi. Questo apre potenziali strade terapeutiche: farmaci che mirano a ridurre questo stress potrebbero essere utili? Inoltre, proteine come HSP60, la cui espressione cambia significativamente, potrebbero diventare potenziali biomarcatori da cercare nel liquido interstiziale (o forse anche nel sangue, sebbene con più difficoltà) per diagnosticare la malattia o monitorarne la progressione.
Certo, questo è uno studio su modelli animali, e la FPI umana è complessa. Ma i risultati sono promettenti. Ci forniscono una mappa più dettagliata dei meccanismi molecolari all’opera e suggeriscono che guardare nel liquido interstiziale è una strategia valida per scovare nuovi segnali della malattia. La speranza è che queste scoperte possano, un giorno, tradursi in strumenti diagnostici più precoci e accurati e in terapie più efficaci per chi combatte contro la fibrosi polmonare. La ricerca continua, e ogni piccolo passo ci avvicina a comprendere e sconfiggere questa malattia.

Fonte: Springer