Il Tesoro Nascosto nelle Bucce di Cacao: Vi Racconto la Scoperta di un Enzima Superpotente!
Ciao a tutti! Oggi voglio portarvi con me in un viaggio affascinante, un’avventura scientifica che parte da qualcosa che molti considerano solo uno scarto: le bucce delle fave di cacao. Sì, avete capito bene! Proprio lì, in quello che rimane dopo aver preso il prezioso seme per fare il cioccolato, abbiamo scovato qualcosa di veramente speciale.
Immaginate un mondo dove gli scarti industriali, invece di essere un problema, diventano una risorsa. È un po’ quello che facciamo noi ricercatori quando andiamo a caccia di microrganismi “utili”. E indovinate un po’? Le bucce di cacao, ricche di nutrienti e con un ambiente un po’ acido, sono un BeB di lusso per certi batteri!
La Caccia al Tesoro Microbico
La nostra storia inizia in Nigeria, precisamente nella zona di Idanre, famosa per il suo cacao. Lì, tra i cumuli di bucce di cacao messe da parte (tecnicamente chiamate CPH – Cocoa Pod Husk), abbiamo iniziato la nostra ricerca. Sapevamo che in quell’ambiente potevano nascondersi microrganismi capaci di fare cose straordinarie, in particolare di “digerire” molecole complesse come l’amido.
Perché l’amido? Perché è una fonte enorme di energia, ma la sua struttura ramificata lo rende difficile da sfruttare al massimo. Pensate alle industrie alimentari, a quelle che producono biocarburanti o farmaci: tutte loro potrebbero beneficiare enormemente da un modo più efficiente per rompere queste catene complesse. Ed è qui che entra in gioco il nostro protagonista: un enzima chiamato pullulanasi.
Identikit di un Enzima Speciale: La Pullulanasi
La pullulanasi (che ha la sigla un po’ tecnica EC 3.2.1.41) è un enzima “debranching”, cioè specializzato nel tagliare i legami specifici (chiamati α-1,6-glicosidici) che creano le ramificazioni nell’amido e in polisaccaridi simili. È come avere delle forbici molecolari super precise! Esistono due tipi principali, Tipo I e Tipo II, con capacità leggermente diverse, ma entrambe sono preziose per l’industria, soprattutto per aumentare la resa di glucosio nella lavorazione dell’amido.
Il problema è che i processi industriali sono spesso “tosti”: temperature alte (50-60 °C), pH acidi (intorno a 4.5). Serve quindi una pullulanasi che non solo funzioni bene, ma che sia anche robusta e stabile in queste condizioni difficili. E dove trovarla? Spesso, i microrganismi che vivono in ambienti “estremi” (come le bucce di cacao in fermentazione) sono una miniera d’oro per questi enzimi super resistenti.
Il Nostro Campione: Bacillus licheniformis FAO.CP7
Dopo un po’ di lavoro di laboratorio, isolando e testando vari batteri dalle bucce di cacao essiccate e macinate, abbiamo trovato un candidato promettente: un ceppo che abbiamo chiamato Bacillus licheniformis FAO.CP7. Questo batterio non è patogeno ed è noto per essere coinvolto nella fermentazione del cacao, dove si nutre della polpa ricca di zuccheri e altre sostanze.
Abbiamo fatto tutti i test del caso: osservazioni al microscopio (è un batterio Gram-positivo, a forma di bastoncello, che forma spore), test biochimici (ama il glucosio, il lattosio, l’amido, ma non l’arabinosio, per esempio; è positivo alla catalasi e alla riduzione dei nitrati) e, ovviamente, l’analisi del suo DNA. Abbiamo amplificato e sequenziato il suo gene 16S rRNA (una specie di codice a barre molecolare per i batteri) e confermato la sua identità: appartiene proprio alla famiglia dei Bacillus licheniformis. Il suo codice genetico è stato depositato nella banca dati mondiale GenBank con il numero di accesso MN150530.1. Curiosamente, cresce ottimamente a 50°C e pH 6.0, condizioni già interessanti per l’industria!

Scavando nel DNA: Alla Scoperta del Gene PulA
Il bello doveva ancora venire! Sapevamo che il nostro B. licheniformis era bravo a usare l’amido, quindi doveva avere il gene per la pullulanasi. Ci siamo messi al lavoro per trovarlo, amplificarlo e sequenziarlo. E voilà! Abbiamo identificato il gene, che abbiamo chiamato PulA.
Questo gene è lungo 2247 paia di basi e contiene le istruzioni per costruire una proteina pullulanasi composta da 748 amminoacidi. Usando strumenti bioinformatici (il nostro laboratorio virtuale!), abbiamo tradotto questa sequenza genetica e iniziato ad analizzare la proteina risultante.
La Proteina PulA Sotto la Lente d’Ingrandimento (Virtuale)
Che cosa abbiamo scoperto su questa proteina PulA?
- Peso e Carica: Ha un peso molecolare di circa 82.39 kDa e un punto isoelettrico (una misura legata alla sua carica elettrica) di 6.47. Questo suggerisce che lavora al meglio in ambienti neutri o leggermente acidi, il che è ottimo per le applicazioni industriali!
- Solubilità: Ha un punteggio di idrofobicità di -0.37. Tradotto: le piace stare in acqua, è una proteina solubile. Questo è importante perché significa che viene secreta dal batterio all’esterno (extracellulare) e non rimane intrappolata nella membrana cellulare. Più facile da raccogliere e usare!
- Termostabilità: Qui arriva il pezzo forte. Abbiamo calcolato il suo “indice alifatico” (77.66) e predetto la sua temperatura di fusione (Tm) usando un software chiamato SCooP. Risultato? Una Tm impressionante di 71.2 °C! Questo indica che la proteina è molto stabile anche a temperature elevate, una caratteristica super desiderabile per l’industria. È quasi al livello di enzimi provenienti da batteri termofili “estremi”, anche se il nostro B. licheniformis è tecnicamente un mesofilo (ama temperature moderate).
- Tipo di Pullulanasi: Analizzando la sequenza di amminoacidi, abbiamo trovato un “motivo” caratteristico, una sequenza specifica (YNWGYNP), che è la firma delle pullulanasi di Tipo I. Queste sono specializzate nel tagliare solo i legami α-1,6.
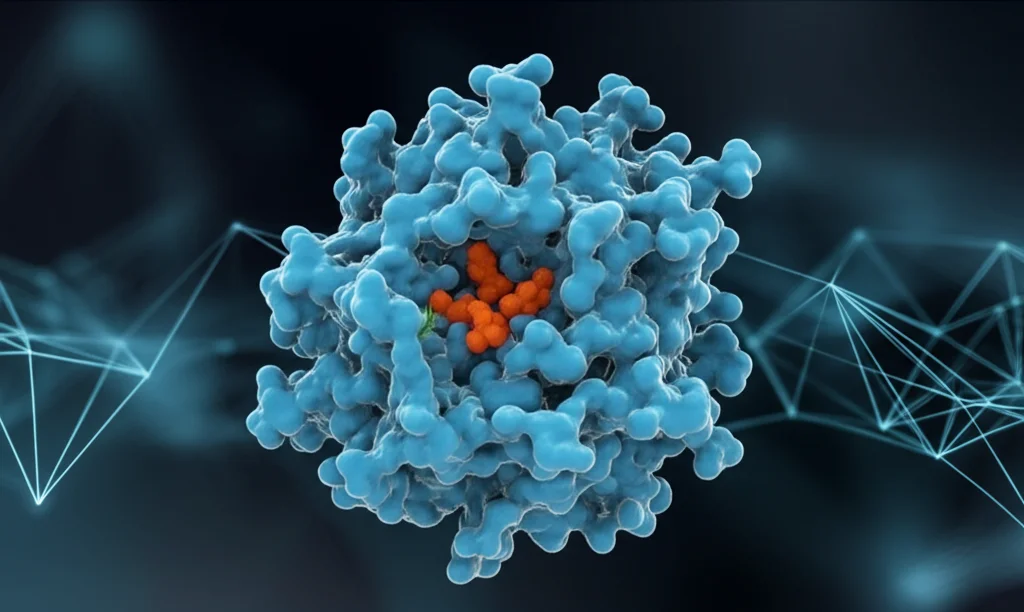
- Struttura 3D e Sito Attivo: Non ci siamo fermati qui! Abbiamo usato modelli computerizzati (come Swiss-Model) per predire come questa proteina si ripiega nello spazio, creando la sua struttura tridimensionale. Abbiamo anche identificato gli amminoacidi chiave nel “sito attivo”, la zona dove avviene la magia del taglio dell’amido. Tre di questi (Asp436, Glu465, Asp548) formano la “triade catalitica”, il cuore pulsante dell’enzima. Abbiamo validato questo modello 3D con vari strumenti (Procheck, ProSA, Verify3D) che ci hanno confermato la buona qualità e affidabilità della struttura predetta. Certo, qualche piccola area sembra un po’ più “flessibile”, ma nel complesso la struttura è solida.
Manipolabile e Pronta per l’Industria?
Un’altra scoperta interessante è stata l’analisi della mappa di restrizione del gene PulA. In pratica, abbiamo visto quali “forbici molecolari” (enzimi di restrizione) possono tagliare questo gene. La buona notizia è che ce ne sono molte (HindIII, PstI, SacI, ecc.), il che significa che il gene è facilmente manipolabile per esperimenti di clonazione ed espressione genica. Questo apre le porte all’ingegneria proteica: potremmo provare a modificare leggermente l’enzima per renderlo ancora più efficiente, specifico o stabile!
Cosa Significa Tutto Questo?
Abbiamo isolato un batterio interessante da un sottoprodotto agricolo (le bucce di cacao), abbiamo trovato il gene per un enzima pullulanasi, e abbiamo scoperto, tramite analisi al computer (in silico), che questa proteina ha caratteristiche fantastiche: è solubile, molto stabile al calore e appartiene al Tipo I, utile per specifiche applicazioni industriali.
Questa pullulanasi da Bacillus licheniformis FAO.CP7 è una candidata promettente per migliorare processi come la produzione di sciroppi di glucosio, la birrificazione, e forse anche la produzione di biocarburanti da materiali amidacei. È un esempio perfetto di come la biodiversità microbica, anche quella nascosta negli “scarti”, possa offrire soluzioni innovative per le sfide industriali.
Ovviamente, questo è solo l’inizio. Le analisi al computer sono potentissime, ma ora serviranno studi in vitro, cioè esperimenti reali in laboratorio, per confermare il peso molecolare esatto, la termostabilità misurata e la temperatura di fusione della proteina purificata. Ma le premesse sono davvero entusiasmanti! Chi l’avrebbe mai detto che le bucce di cacao potessero nascondere un simile potenziale biotecnologico? La natura non smette mai di sorprenderci!
Fonte: Springer







