Scaffold Conduttivi con un Tocco Magico: Rivoluzionare la Rigenerazione dei Tessuti!
Amici scienziati (e non)! Oggi voglio parlarvi di una cosa che mi sta particolarmente a cuore e che, credetemi, ha del rivoluzionario. Immaginate di poter aiutare il corpo a rigenerare i tessuti danneggiati, come se avessimo una bacchetta magica. Beh, non abbiamo (ancora!) la bacchetta, ma abbiamo la scienza, e in particolare l’ingegneria tissutale! E in questo campo, c’è un materiale che sta facendo faville, o meglio, scintille… letteralmente!
Un’impalcatura per le nostre cellule: ecco lo scaffold!
Quando un tessuto è danneggiato, le cellule hanno bisogno di un “aiutino” per ricrescere nel modo giusto. Pensate a una casa in costruzione: serve un’impalcatura, giusto? Ecco, nell’ingegneria tissutale usiamo degli “scaffold”, delle strutture tridimensionali che guidano le cellule. Nel nostro caso, abbiamo lavorato su scaffold a forma di dischetto, spessi circa 3-4 mm e con un diametro di 10 mm, fatti principalmente di acido poliacrilico (PAA) e acido ialuronico (HA). Questi due sono un po’ come il pane e burro degli idrogel: biocompatibili, amano l’acqua e l’HA è pure un componente naturale dei nostri tessuti. Aggiungiamoci anche la lignina (LIG), una sostanza che deriva dal legno e che, sorpresa sorpresa, dà una bella robustezza meccanica alla struttura. Sembra un mix perfetto, no?
Ma c’è un “ma”. Il PAA, pur essendo un bravo ragazzo, non è il massimo quando si tratta di far attaccare le cellule. E anche l’HA, sebbene abbia dei siti di legame specifici, a volte può “respingere” le cellule se non ci sono le condizioni giuste, un po’ come due calamite con la stessa polarità. E qui entra in gioco la nostra prima innovazione: rendere questi scaffold elettricamente conduttivi! Perché? Perché i nostri tessuti, specialmente quelli nervosi e cardiaci, comunicano anche tramite segnali elettrici. Dare una “scossa” (controllata, eh!) alle cellule può stimolarle a crescere meglio, differenziarsi e allinearsi. Per farlo, abbiamo incorporato delle nanoparticelle di PEDOT:HA (poli(3,4-etilendiossitiofene):acido ialuronico). Immaginatele come minuscole autostrade per i segnali elettrici all’interno del nostro scaffold.
Il problema: le cellule facevano le timide!
Nonostante questi scaffold fossero porosi, conduttivi, assorbenti e meccanicamente resistenti (grazie alla lignina!), c’era un piccolo intoppo: le cellule, in particolare i fibroblasti L929 che abbiamo usato nei test, non sembravano molto entusiaste di attaccarsi e proliferare. Un po’ come invitare qualcuno a una festa super tecnologica, ma con sedie scomodissime. Bisognava fare qualcosa per rendere la “superficie” più accogliente.
Ed è qui che abbiamo avuto l’idea geniale: perché non “vestire” i nostri scaffold con un abito su misura per le cellule? Un rivestimento che le invogliasse a fermarsi, mettersi comode e iniziare a fare il loro lavoro di rigenerazione. Questa tecnica si chiama rivestimento polielettrolitico multistrato (PEM), e consiste nel depositare strati alternati di polimeri con carica opposta, un po’ come fare una lasagna molecolare!
La “lasagna” molecolare che fa impazzire le cellule
Per il nostro “vestito” cellulare, abbiamo scelto due protagonisti ben noti per la loro biocompatibilità: la poli(L-lisina) (PLL), con carica positiva, e di nuovo l’acido ialuronico (HA), con carica negativa. Abbiamo immerso i nostri scaffold prima in una soluzione di PLL, poi risciacquato, poi in una di HA, risciacquato, e così via, creando strati su strati. Un processo chiamato “layer-by-layer” (strato su strato). Abbiamo testato configurazioni con 4 coppie di strati più uno finale di PLL, e con 8 coppie più PLL finale.
Come abbiamo fatto a sapere se il rivestimento aveva funzionato? Beh, abbiamo usato un arsenale di tecniche!
- Misure dell’angolo di contatto: per vedere come l’acqua interagiva con la superficie (più strati, più idrofobicità, segno che qualcosa era cambiato).
- Microscopia a fluorescenza: usando una PLL marcata con fluoresceina, abbiamo visto letteralmente gli strati illuminarsi e aumentare lo spessore dello scaffold.
- Microscopia elettronica a scansione (SEM): questa ci ha dato delle immagini spettacolari della superficie, che da liscia è diventata granulare e squamosa, segno del nuovo “vestito”. E non solo in superficie! Il rivestimento era penetrato anche un po’ all’interno dei pori.
- Spettroscopia FTIR: per analizzare le “impronte digitali” chimiche e confermare la presenza dei nuovi gruppi funzionali del PLL.
E sapete la cosa più sorprendente? Questi strati PEM non solo hanno reso gli scaffold più “belli” per le cellule, ma hanno portato anche dei benefici inaspettati! La resistenza alla compressione è aumentata notevolmente (da circa 129 kPa a oltre 500 kPa!), mentre il gonfiore (swelling) è diminuito. Praticamente, il rivestimento ha rinforzato la struttura e, forse, ostruendo un po’ i percorsi di diffusione, ha limitato l’assorbimento d’acqua. Meno “gonfi”, più robusti: niente male come effetto collaterale!

Finalmente, le cellule fanno festa!
Ma veniamo al dunque: le cellule hanno gradito il nuovo look? Assolutamente sì! I test di adesione e proliferazione con i fibroblasti L929 sono stati un trionfo.
Sui campioni non rivestiti, le povere cellule erano pochine, per lo più sferiche, segno che non si sentivano a loro agio, non riuscivano ad “aggrapparsi” bene. Invece, sugli scaffold rivestiti con PLL/HA, la musica è cambiata radicalmente! Le cellule erano molte di più, ben adese, e mostravano la loro tipica morfologia fusiforme, allungata, segno che stavano benone e proliferavano allegramente. L’analisi con Alamar Blue ha confermato un aumento significativo della vitalità e proliferazione cellulare nei campioni rivestiti, specialmente dopo 48 e 72 ore. Addirittura, il campione con 8 coppie di strati (PLL/HA)8-PLL ha mostrato la proliferazione più alta di tutti!
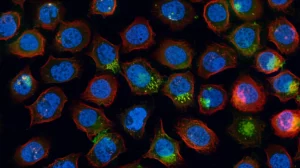
Le immagini LIVE/DEAD (cellule vive in verde, morte in rosso) e quelle con colorazione DAPI/Actina (nuclei in blu, citoscheletro in verde) hanno parlato chiaro: densità cellulare alle stelle e morfologia da manuale sui campioni rivestiti. Un successo su tutta la linea!
La giusta dose di “scintilla”: ottimizzare le nanoparticelle
Contenti di questo risultato, ci siamo chiesti: qual è la quantità ottimale di nanoparticelle conduttive PEDOT:HA da inserire? Troppe potrebbero compromettere le proprietà meccaniche o la biocompatibilità? Troppo poche renderebbero lo scaffold poco conduttivo?
Abbiamo quindi preso il nostro campione rivestito preferito, quello con 4 coppie di strati (PLL/HA)4-PLL (che aveva già ottime proprietà biologiche e meccaniche con uno spessore di rivestimento inferiore rispetto a quello da 8), e abbiamo testato diverse concentrazioni di nanoparticelle: 0% (controllo), 0.5%, 1% e 2% (peso/volume).
I risultati sono stati illuminanti (è il caso di dirlo!):
- Con il 2% di nanoparticelle: la conduttività era la più alta, fantastico! Però… le proprietà meccaniche ne hanno risentito parecchio. Lo scaffold era diventato troppo “molle”, poco stabile, e anche le cellule non sembravano gradire molto, mostrando scarsa adesione e proliferazione. Probabilmente, troppe nanoparticelle tendono ad agglomerarsi e interferiscono con la reticolazione dell’idrogel.
- Con lo 0.5% di nanoparticelle: le proprietà meccaniche e la biocompatibilità erano ottime, simili al campione con l’1%. Però, la conduttività era significativamente più bassa, quasi come il campione senza nanoparticelle. Segno che non avevamo ancora raggiunto la “soglia di percolazione”, quel punto in cui le nanoparticelle formano una rete continua per il passaggio della corrente.
- Con l’1% di nanoparticelle: Bingo! Questo campione ha mostrato l’equilibrio perfetto. Ottime caratteristiche meccaniche (resistenza a compressione intorno ai 522 kPa), conduttività significativamente più alta rispetto allo 0.5% (siamo passati da circa 8.2 x 10-6 S/cm a 4.7 x 10-5 S/cm), e una biocompatibilità eccellente, con alta adesione e proliferazione cellulare.

È interessante notare che le nanoparticelle PEDOT:HA sono cariche negativamente, quindi si potrebbe pensare che interferiscano con la deposizione degli strati di HA. Tuttavia, le misure dell’angolo di contatto hanno mostrato un chiaro aumento dopo il primo strato di PLL (positivo), indicando un rivestimento efficace. Inoltre, la netta riduzione del gonfiore e le immagini SEM suggeriscono un rivestimento completo, quindi sembra che le nostre nanoparticelle non abbiano disturbato più di tanto il processo di “vestizione”.
Cosa ci riserva il futuro?
Quindi, cosa abbiamo imparato? Che rivestire i nostri scaffold PAA/HA/Lignina/PEDOT:HA con strati di PLL e HA è stata una mossa vincente per migliorare drasticamente la loro biocompatibilità. E che la concentrazione dell’1% di nanoparticelle PEDOT:HA nel campione (PLL/HA)4-PLL sembra essere la formula magica per un equilibrio ideale tra proprietà meccaniche, conduttività e risposta biologica.
Questi scaffold conduttivi e bioattivi aprono scenari davvero promettenti. Pensate alle applicazioni nell’ingegneria tissutale per riparare nervi o tessuto cardiaco, nella guarigione delle ferite (dove la stimolazione elettrica può fare miracoli), o persino nello sviluppo di biosensori capaci di monitorare in tempo reale la salute delle cellule.
Certo, la strada è ancora lunga. Ad esempio, sarebbe interessante studiare la degradazione di questi rivestimenti nel tempo e in condizioni che simulino l’ambiente del corpo umano. Ma ogni passo avanti, come questo, ci avvicina a soluzioni sempre più efficaci per aiutare il nostro corpo a guarire. E per me, questa è la parte più affascinante della scienza!
Fonte: Springer