SARM1: La Nuova Frontiera per Difendere il Nostro Cervello dai Virus?
Virus all’attacco del cervello: un nemico subdolo
Ciao a tutti! Oggi voglio parlarvi di un argomento che mi affascina e, allo stesso tempo, mi preoccupa un po’: le encefaliti virali. Si tratta di infezioni acute del nostro sistema nervoso centrale causate da virus che hanno una predilezione particolare per i neuroni, i cosiddetti virus neurotropici. Pensate a nemici invisibili che riescono a infiltrarsi nella nostra “centrale di comando”, il cervello, causando danni neurologici seri, infiammazione e, purtroppo, tassi di mortalità e disabilità piuttosto alti. Patologie come quelle causate dal virus dell’encefalite giapponese (JEV), dall’herpes simplex di tipo 1 (HSV-1) o dal virus della rabbia (RABV) rientrano in questa categoria.
Il problema grosso è che, nonostante i progressi nella diagnosi, le terapie mirate scarseggiano. Certo, abbiamo l’aciclovir per l’encefalite da HSV, ma per molte altre forme brancoliamo un po’ nel buio, affidandoci a trattamenti più empirici. Questo ci porta a una domanda cruciale: esiste forse una via comune, un meccanismo patologico condiviso da queste diverse infezioni che potremmo bloccare per proteggere il cervello?
SARM1: un interruttore per la degenerazione neuronale?
Ed è qui che entra in gioco una proteina dal nome un po’ tecnico, ma dal ruolo potenzialmente rivoluzionario: SARM1 (Sterile α and Toll/IL-1 receptor motif–containing 1). Immaginate SARM1 come un interruttore molecolare. In condizioni normali, se ne sta tranquillo, ma quando le cose si mettono male per un neurone, specialmente per i suoi lunghi “cavi” di comunicazione, gli assoni, SARM1 si attiva.
Cosa lo fa scattare? Sembra essere un sensore metabolico. Quando l’equilibrio tra due molecole importanti, NMN (nicotinamide mononucleotide) e NAD+ (nicotinamide adenina dinucleotide), si sbilancia a favore del primo, SARM1 si accende. Una volta attivo, SARM1 agisce come un enzima che “mastica” il NAD+ residuo, producendo altre molecole come il cADPR (ADP-ribosio ciclico). Questa deplezione di NAD+ scatena una cascata di eventi che portano alla degenerazione assonale, ovvero alla distruzione dei “cavi” neuronali. Questo processo è un problema serio in tantissime malattie neurologiche, dall’Alzheimer al Parkinson, e spesso precede la morte vera e propria del neurone.
Ma non è tutto! SARM1 non si limita a danneggiare gli assoni. Il suo dominio TIR (lo stesso presente in recettori importanti per l’immunità) partecipa anche ai meccanismi di neuroinfiammazione, regolando la produzione di citochine e chemochine, molecole che orchestrano la risposta infiammatoria nel cervello. Insomma, SARM1 sembra essere un mediatore chiave sia del danno diretto ai neuroni sia dell’infiammazione che ne consegue.
L’indagine: SARM1 e le encefaliti virali sotto la lente
Visto il ruolo di SARM1 in altre neuropatie, ci siamo chiesti: cosa succede durante un’encefalite virale? SARM1 si attiva anche in questo caso? E se sì, contribuisce al danno? Per capirlo, abbiamo messo a punto dei modelli animali (topolini, per la precisione) di encefalite, infettandoli con i virus che vi ho menzionato prima: JEV, HSV-1 e RABV.
I risultati sono stati illuminanti! Abbiamo osservato che, nei topi infettati, l’espressione di SARM1 nei neuroni della corteccia cerebrale aumentava. Contemporaneamente, i livelli di un enzima che produce NAD+ (chiamato NMNAT2) diminuivano, e con essi calavano anche i livelli di NAD+. Al contrario, i livelli di cADPR, la “firma” dell’attività di SARM1, aumentavano. Proprio come ipotizzato! E, purtroppo, abbiamo anche visto una massiccia degenerazione assonale nella corteccia dei topi malati. Un altro indizio interessante è stato l’aumento nel sangue di una proteina chiamata catena leggera del neurofilamento (Nf-L), un noto biomarcatore del danno assonale, che aumentava proprio in concomitanza con i sintomi neurologici.
La svolta: bloccare SARM1 per proteggere il cervello
A questo punto, la domanda era ovvia: se SARM1 è parte del problema, possiamo trasformarlo in parte della soluzione? Cosa succede se lo blocchiamo? Abbiamo provato due strade:
- Utilizzare topolini geneticamente modificati in cui il gene Sarm1 era stato eliminato (Sarm1 KO).
- Somministrare ai topolini normali (wild-type, WT) degli inibitori specifici di SARM1, come una molecola chiamata SIC4, o un’altra sostanza, FK866, che agisce più a monte impedendo l’accumulo di NMN che attiva SARM1.
I risultati sono stati davvero incoraggianti! Sia nei topi KO sia in quelli trattati con gli inibitori, abbiamo osservato una netta riduzione della degenerazione assonale dopo l’infezione con JEV e HSV-1. Gli assoni rimanevano molto più integri rispetto ai topi non trattati. Anche nel caso dell’infezione da RABV, pur essendo un virus un po’ diverso nel suo modo di agire, l’inibizione di SARM1 ritardava il danno assonale. È importante sottolineare che questo effetto protettivo non dipendeva da una riduzione della replicazione virale: il virus c’era ancora, ma faceva meno danni agli assoni! Coerentemente, anche i livelli del biomarcatore Nf-L nel sangue erano significativamente più bassi nei topi protetti.
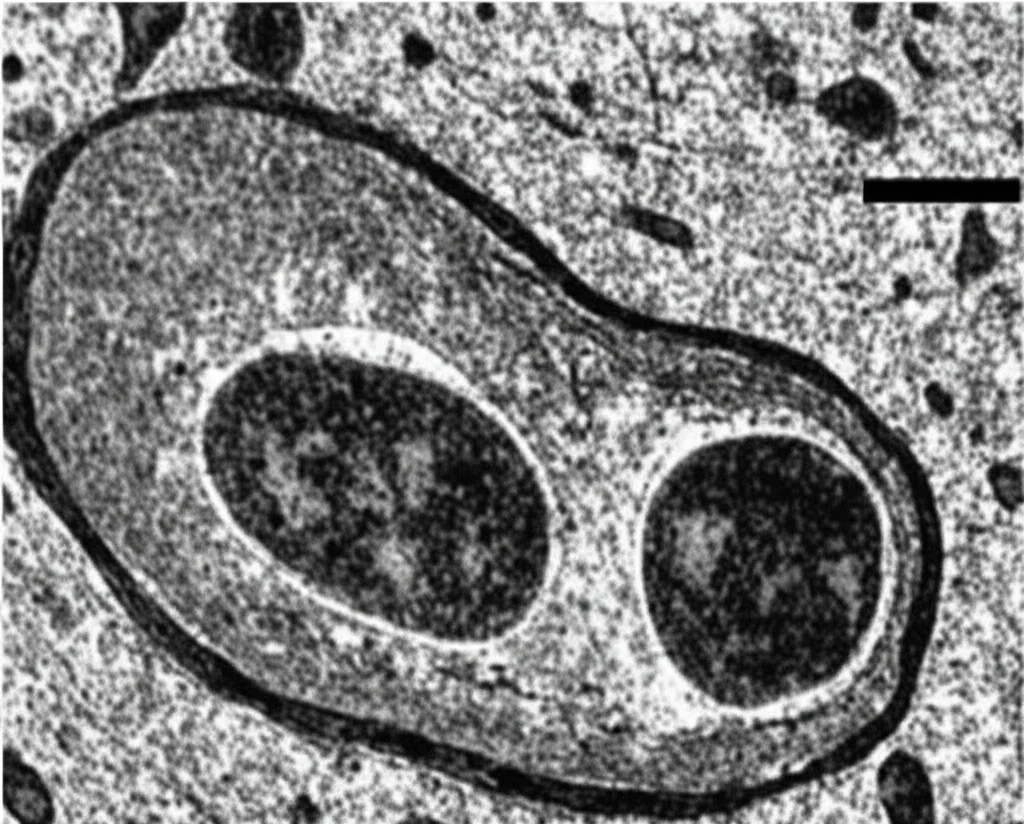
SARM1 e le centrali energetiche: un legame pericoloso
Ma come fa SARM1 a innescare la degenerazione? Sembra che uno dei suoi bersagli principali siano i mitocondri, le vere e proprie centrali energetiche dei nostri neuroni. Abbiamo visto che, durante l’infezione virale, SARM1 tende a localizzarsi proprio sui mitocondri. E questa non è una buona notizia.
Studiando cellule neuronali infettate (in particolare con JEV), abbiamo scoperto che l’attivazione di SARM1 porta a una perdita del potenziale di membrana mitocondriale (un indicatore di sofferenza della “centrale energetica”) e a un’alterazione dell’omeostasi del calcio, con un aumento del calcio nel citoplasma. Entrambi sono segnali di grave disfunzione mitocondriale. E indovinate un po’? Trattando le cellule con l’inibitore SIC4, questi effetti negativi venivano attenuati!
Andando ancora più a fondo, con la microscopia elettronica (che ci permette di vedere dettagli piccolissimi), abbiamo esaminato i mitocondri negli assoni dei topi infettati. Nei topi normali infettati con JEV, i mitocondri apparivano danneggiati: gonfi, con le loro strutture interne (le creste) ridotte o scomparse. Al contrario, nei topi trattati con SIC4 o nei topi Sarm1 KO, i mitocondri mantenevano un aspetto molto più sano, quasi normale, nonostante l’infezione. Questo suggerisce che il danno mitocondriale SARM1-dipendente sia un meccanismo chiave attraverso cui i virus neurotropici portano alla degenerazione assonale.
Non solo assoni: SARM1 alimenta anche l’infiammazione
Come accennavo, SARM1 non si occupa solo di degenerazione, ma anche di infiammazione. E anche qui, bloccarlo ha portato benefici. Nei topi Sarm1 KO infettati con JEV o HSV-1, abbiamo riscontrato una significativa riduzione dei danni generali al tessuto cerebrale (meno gliosi, meno emorragie, meno cellule infiammatorie infiltrate) rispetto ai topi normali. Anche la perdita di neuroni era minore. Di conseguenza, i topi KO mostravano sintomi più lievi e, soprattutto per JEV e HSV-1, avevano tassi di sopravvivenza decisamente migliori! Nel caso di RABV, la delezione di SARM1 ritardava la malattia e allungava la sopravvivenza, ma non impediva l’esito fatale, confermando che questo virus ha meccanismi patogenetici un po’ particolari.
Abbiamo anche misurato i livelli di molecole pro-infiammatorie (citochine come IFN-γ, TNF-α, IL-6) nella corteccia. Nei topi KO infettati con JEV o HSV-1, questi livelli erano molto più bassi. Interessante notare che, anche a lungo termine (35 giorni dopo l’infezione da HSV-1), nei topi KO sopravvissuti, le cellule della glia (microglia e astrociti), che normalmente si attivano cronicamente dopo un danno, erano tornate a uno stato quiescente, mentre nei topi normali sopravvissuti rimanevano attive, associate a livelli più alti di citochine. Questo indica che SARM1 contribuisce sia all’infiammazione acuta che a quella cronica.
Inibitori di SARM1: una nuova speranza terapeutica?
I risultati ottenuti con i topi KO sono stati confermati anche con il trattamento farmacologico. Somministrando FK866 o SIC4 ai topi normali dopo l’infezione, abbiamo osservato un ritardo nell’insorgenza dei sintomi, una riduzione della gravità della malattia, una minore patologia cerebrale (meno infiammazione, meno perdita neuronale) e un aumento della sopravvivenza (di nuovo, soprattutto per JEV e HSV-1).
Un dato curioso riguarda le cellule della glia. Mentre l’inibizione di SARM1 non sembrava influenzare direttamente la microglia, riduceva significativamente l’attivazione degli astrociti, altre cellule importantissime nel cervello che supportano i neuroni ma possono anche contribuire all’infiammazione. Inoltre, abbiamo visto che il trattamento con FK866 o SIC4 riduceva l’infiltrazione nel cervello di cellule immunitarie provenienti dal sangue (leucociti CD45+). Quindi, gli inibitori di SARM1 sembrano agire su più fronti: proteggono direttamente gli assoni e i mitocondri, e modulano la risposta infiammatoria, in parte agendo sugli astrociti e riducendo l’arrivo di “rinforzi” infiammatori dal sangue.
Conclusioni (e prospettive future)
Cosa ci portiamo a casa da tutto questo? Beh, sembra proprio che SARM1 sia un attore chiave nella partita che si gioca nel nostro cervello durante le encefaliti virali. La sua attivazione, innescata dall’infezione, contribuisce in modo determinante alla degenerazione assonale, alla disfunzione mitocondriale e alla neuroinfiammazione, peggiorando l’esito della malattia.
La scoperta più entusiasmante è che bloccare SARM1, sia geneticamente sia farmacologicamente, offre una protezione significativa, preservando la struttura e la funzione neuronale, smorzando l’infiammazione e migliorando la sopravvivenza nei nostri modelli animali. Questo apre scenari terapeutici davvero promettenti! Gli inibitori di SARM1, come FK866 e SIC4, potrebbero rappresentare una nuova classe di farmaci neuroprotettivi non solo per le encefaliti virali, per le quali oggi abbiamo poche armi, ma potenzialmente anche per altre malattie neurodegenerative caratterizzate da danno assonale e disfunzione mitocondriale.
Certo, la strada è ancora lunga, servono ulteriori ricerche per capire tutti i dettagli e per traslare questi risultati nell’uomo. Ma aver identificato un bersaglio molecolare così cruciale come SARM1 ci dà una speranza concreta per sviluppare terapie più efficaci contro queste devastanti infezioni virali del cervello. Incrociamo le dita!
Fonte: Springer