Sarcoma Retroperitoneale: La TAC Svela il Rischio Metastasi Grazie all’Intelligenza Artificiale!
Amici appassionati di scienza e medicina, oggi voglio parlarvi di una sfida che noi medici affrontiamo spesso: il sarcoma retroperitoneale (RPS). Immaginate una massa tumorale che cresce subdola nell’addome, dietro gli organi principali. È un tipo di cancro parecchio eterogeneo, il che significa che ogni paziente, anche con uno stadio clinico simile, può avere un rischio completamente diverso di sviluppare metastasi a distanza (DM). E capire chi è più a rischio è fondamentale per decidere la strategia terapeutica migliore.
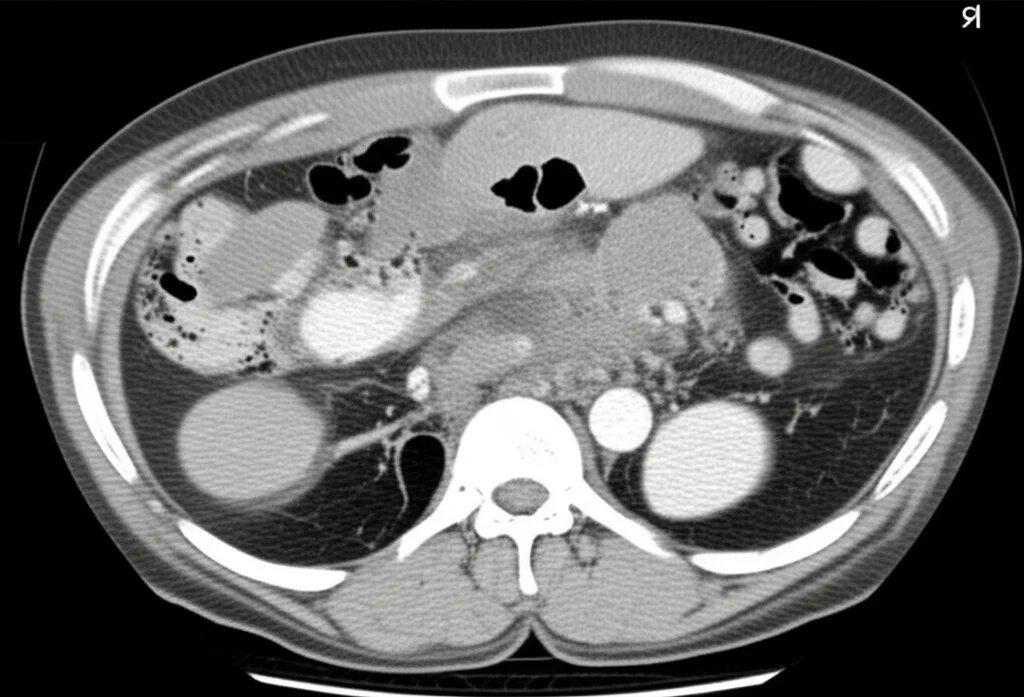
Ecco, proprio su questo fronte c’è una novità super interessante che arriva da uno studio recente. Si è cercato di mettere a punto un metodo quantitativo per “leggere” questa eterogeneità interna al tumore (chiamata eterogeneità intratumorale o ITH) usando le scansioni TC con mezzo di contrasto (CECT) fatte prima dell’intervento. L’obiettivo? Prevedere il rischio di metastasi. Vi assicuro che non è fantascienza, ma il frutto di un lavoro meticoloso su 274 pazienti operati e seguiti per almeno tre anni. Un bel campione, no?
Cosa sono i Sarcomi Retroperitoneali e perché le metastasi sono un problema
Prima di addentrarci nei dettagli tecnici, facciamo un piccolo passo indietro. I sarcomi retroperitoneali sono tumori rari ma aggressivi. Tra i più comuni ci sono i liposarcomi e i leiomiosarcomi. La terapia standard è la chirurgia radicale, cioè togliere tutto il tumore. Il problema è che, nonostante un intervento perfetto, una fetta importante di pazienti (dal 30% al 50%!) sviluppa metastasi entro cinque anni. E quando il sarcoma dà metastasi, la prognosi purtroppo peggiora drasticamente, con una sopravvivenza mediana di soli 16 mesi.
Si sta lavorando molto su terapie pre-operatorie, come la radioterapia neoadiuvante, che sembra aiutare a ottenere una resezione completa e a ridurre le metastasi peritoneali, anche se ci sono ancora dibattiti sulla sua tossicità. Anche la chemioterapia neoadiuvante è sotto i riflettori, con studi in corso. Insomma, la tendenza è verso strategie sempre più personalizzate e interventi precoci. Capite bene, quindi, quanto sia cruciale identificare prima dell’operazione quei pazienti con un alto potenziale di sviluppare metastasi. È qui che entra in gioco la tecnologia.
La TC, la Radiomica e il Deep Learning: Un Trio Invincibile?
Le linee guida raccomandano la TC con contrasto (CECT) per monitorare questi tumori. La CECT ci dà una visione completa del tessuto tumorale, catturando informazioni sulla morfologia e sulla texture. Pensate che l’eterogeneità genomica del tumore può portare a variazioni nella composizione cellulare, che a loro volta si manifestano come differenze, locali o globali, nelle immagini. Il guaio è che l’interpretazione tradizionale della CECT si concentra soprattutto sulla morfologia macroscopica, e molte caratteristiche “nascoste”, invisibili all’occhio umano ma rilevanti per le metastasi, sfuggono. Senza contare che il giudizio dipende molto dall’esperienza del radiologo.
Ed ecco che la radiomica e il deep learning (DL) ci vengono in soccorso. Queste tecniche possono imparare autonomamente informazioni rappresentative dalle immagini CECT, estraendo caratteristiche che noi non vedremmo mai, senza bisogno di intervento umano. Pensate un po’, alcuni studi hanno già mostrato come la radiomica possa predire il tipo istologico e il grado del sarcoma retroperitoneale con ottime performance, o come il deep learning possa prevedere le metastasi nei leiomiosarcomi retroperitoneali.
Tuttavia, finora, ci si era concentrati soprattutto sulle caratteristiche generali del tumore, senza scavare a fondo nel significato predittivo dell’eterogeneità interna (ITH) per il rischio di metastasi. Eppure, l’ITH è una bella gatta da pelare nelle scelte terapeutiche e nel follow-up, ed è noto che giochi un ruolo nella progressione tumorale e negli esiti clinici sfavorevoli. Immaginate il tumore non come una massa uniforme, ma come un “ecosistema” complesso e variegato. Misurare quantitativamente questa diversità interna potrebbe essere un biomarker preziosissimo.
Lo Studio nel Dettaglio: Come Hanno Fatto?
Nello studio che vi racconto, i ricercatori si sono posti tre obiettivi principali:
- Sviluppare una valutazione quantitativa dell’ITH basata sulle immagini CECT preoperatorie.
- Confrontare l’efficacia predittiva di diversi modelli: quello basato sui dati clinici, quello sulla radiomica convenzionale (C-radiomics), quello sull’ITH e quello sul deep learning.
- Costruire un modello combinato ottimale e valutarne l’efficacia nel predire la sopravvivenza libera da metastasi a distanza (DMFS) nei pazienti con leiomiosarcoma e liposarcoma retroperitoneale dopo resezione completa.
Per farlo, hanno analizzato retrospettivamente i dati di 274 pazienti. Hanno estratto dalle CECT preoperatorie le caratteristiche di radiomica convenzionale, quelle legate all’ITH e quelle derivate dal deep learning. Poi, hanno integrato gli indicatori clinici con queste caratteristiche “high-throughput” per sviluppare un modello combinato. La performance dei modelli è stata valutata con parametri statistici come la curva ROC e l’indice di concordanza di Harrell (C-index).
Una cosa molto interessante è come hanno calcolato l’ITH-score. In pratica, per ogni pixel della regione tumorale hanno estratto 104 caratteristiche di C-radiomics per descrivere l’informazione locale. Poi, hanno raggruppato i pixel in base a queste informazioni locali: pixel nello stesso cluster avevano intensità e texture vicine simili. L’ITH-score, che va da 0 a 1, riflette quanto sia “disseminata” la mappa delle etichette dei cluster: più alto è il punteggio, maggiore è l’eterogeneità nella composizione cellulare e nella distribuzione spaziale all’interno del tessuto. Hanno persino creato delle mappe colorate che rappresentano visivamente questa distribuzione, facilitando la quantificazione dell’ITH.
Per il deep learning, hanno usato un’architettura 2.5D-CNN, addestrata sulle immagini CECT, per prevedere il rischio di metastasi post-operatorie. Hanno anche applicato tecniche di “data augmentation” (come capovolgimenti e rotazioni delle immagini) per evitare che il modello imparasse troppo a memoria i dati di training (il famoso overfitting) e per migliorarne la robustezza.
I Risultati: Cosa Ci Dice Questa Ricerca?
E veniamo ai risultati, la parte più succosa! Il modello basato sull’ITH (ITH model) ha dimostrato una capacità predittiva soddisfacente per le metastasi a distanza sia nel gruppo di validazione interna (AUC: 0.735; C-index: 0.691) che in quello di validazione esterna (AUC: 0.765; C-index: 0.729). Pensate che nel gruppo di validazione esterna ha fatto leggermente meglio del modello clinico e di quello basato sulla radiomica convenzionale.
Ma il vero campione è stato il modello combinato, quello che integrava le variabili clinico-radiologiche, l’ITH-score e il DL-score (punteggio derivato dal deep learning). Questo super-modello ha raggiunto le migliori performance predittive in entrambi i gruppi di validazione (AUC interna: 0.864, esterna: 0.801; C-index interno: 0.770, esterno: 0.752). Non solo, è riuscito a stratificare con successo i pazienti in gruppi ad alto e basso rischio di metastasi. Questo è importantissimo, perché significa poter identificare chi ha bisogno di un trattamento più aggressivo o di un follow-up più stretto.
Tra le variabili clinico-radiologiche, la presenza di spazi cistici o necrosi all’interno del tumore è emersa come il biomarker di imaging più significativo, seguito dallo stadio T clinico. Il modello combinato ha anche mostrato un minor rischio di errori di predizione e un beneficio clinico netto superiore rispetto agli altri modelli.

Un altro aspetto notevole è che, dato che oltre il 65% dei pazienti nello studio aveva un liposarcoma retroperitoneale (RLPS), i ricercatori hanno verificato se il tipo di tumore influenzasse le performance del modello. Ebbene, il modello combinato ha funzionato bene sia per i leiomiosarcomi (RLMS) che per i liposarcomi, senza differenze statisticamente significative tra i due tipi.
Implicazioni Cliniche e Limiti dello Studio
Quindi, cosa ci portiamo a casa da questa ricerca? Beh, l’analisi dell’eterogeneità intratumorale sembra davvero facilitare l’identificazione dei pazienti con sarcoma retroperitoneale ad alto rischio di metastasi e con prognosi peggiore. Questo apre la strada alla selezione di candidati per interventi chirurgici e post-chirurgici più aggressivi e personalizzati. Il modello combinato, in particolare, ha dimostrato un potenziale promettente per predire accuratamente il rischio di metastasi e stratificare il rischio di sopravvivenza libera da metastasi, fornendo uno strumento prezioso per guidare le decisioni terapeutiche e le strategie di follow-up.
Certo, come ogni studio, anche questo ha i suoi limiti. Innanzitutto, è uno studio retrospettivo, quindi soggetto a possibili bias di selezione. Sebbene la validazione esterna aumenti l’affidabilità, la rarità del sarcoma retroperitoneale ha reso necessario l’uso di coorti retrospettive. Sarebbe fantastico vedere questi risultati confermati da studi prospettici.
In secondo luogo, lo studio si è concentrato sui liposarcomi e leiomiosarcomi, che sono i sottotipi più comuni. Quindi, la generalizzabilità del modello a tutti i sottotipi di RPS potrebbe essere limitata. Inoltre, la dimensione del campione, sebbene significativa, potrebbe beneficiare di ulteriori validazioni su dataset multicentrici più ampi. Infine, la delineazione manuale del tumore richiede esperienza ed è soggetta a bias. Un approccio automatizzato e preciso per la segmentazione del tumore sarebbe cruciale per garantire stabilità, riproducibilità e migliorare l’efficienza dell’analisi di imaging.
Nonostante queste considerazioni, i risultati sono davvero incoraggianti. L’idea di usare l’eterogeneità intratumorale come “firma” per predire il comportamento del tumore è affascinante. Il modello combinato che integra l’ITH-score, il DL-score e le variabili clinico-radiologiche si è dimostrato uno strumento efficace per la stratificazione del rischio nei pazienti con RLPS e RLMS. Questo potrebbe davvero aiutarci a prendere decisioni cliniche più mirate, un passo avanti verso una medicina di precisione sempre più efficace. E, come sempre, la ricerca non si ferma qui!
Fonte: Springer