Cancro Orale: S100A7, il Biomarcatore che Svela il Rischio Nascosto nelle Lesioni
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante e, diciamocelo, super importante nel campo della salute orale: la possibilità di prevedere se una lesione apparentemente innocua nella bocca possa trasformarsi in un cancro. Immaginate di poter avere una sorta di “spia” molecolare che ci avvisa del pericolo imminente. Beh, sembra che potremmo averne trovata una promettente: la proteina S100A7.
Il Problema: Quelle Lesioni Sospette nella Bocca
Partiamo dalle basi. A volte, nella mucosa della bocca, possono comparire delle lesioni che non sono ancora cancro, ma nemmeno tessuto perfettamente normale. Le chiamiamo Disordini Potenzialmente Maligni Orali (OPMD). Clinicamente, potreste conoscerle come leucoplachie (macchie bianche) o eritroplachie (macchie rosse). Il vero dilemma è: quali di queste lesioni diventeranno un Carcinoma Squamocellulare Orale (OSCC), un tumore maligno, e quali invece rimarranno tranquille?
Attualmente, la diagnosi si basa sull’analisi al microscopio di un pezzettino di tessuto (biopsia). Gli esperti cercano alterazioni specifiche nell’architettura e nelle cellule dell’epitelio, chiamate displasia epiteliale orale (OED), e le classificano in base alla gravità. Tradizionalmente si usa un sistema a 3 gradi (lieve, moderata, severa), ma recentemente è stato proposto anche un sistema più semplice a 2 gradi (basso rischio, alto rischio).
Il punto dolente? Questi sistemi di grading, pur essendo lo standard, hanno i loro limiti. C’è una certa variabilità tra diversi osservatori (e anche nello stesso osservatore in momenti diversi!) e, soprattutto, non sono infallibili nel predire quali lesioni trasformeranno. Pensate che alcune lesioni classificate come a basso rischio possono evolvere in cancro, mentre altre, apparentemente più gravi, magari non lo fanno. Si parla infatti più di “trasformazione” che di “progressione” lineare. È frustrante, vero? Serve qualcosa di più affidabile.
Entra in Scena S100A7: Una Proteina Sotto i Riflettori
Ed è qui che entra in gioco la nostra protagonista: la proteina S100A7, conosciuta anche come Psoriasina (originariamente scoperta nella pelle affetta da psoriasi). Fa parte di una grande famiglia di proteine che legano il calcio e sembra avere un ruolo in diversi processi, tra cui l’infiammazione e, ahimè, lo sviluppo di vari tipi di cancro, inclusi quelli della testa e del collo e, appunto, della bocca.
Studi recenti hanno iniziato a suggerire che S100A7 potrebbe essere un pezzo importante del puzzle nello sviluppo dell’OSCC. Sembra coinvolta nell’attivazione di vie di segnalazione cellulare (come p38/MAPK, RAB2A e forse beta-catenina/Wnt) che regolano la crescita, la migrazione e l’invasività delle cellule tumorali. Alcune ricerche precedenti avevano già indicato che un’alta espressione di S100A7 nel citoplasma delle cellule displastiche fosse un forte candidato come marcatore di rischio di trasformazione maligna. Addirittura, un sistema di valutazione basato su S100A7 sembrava essere più predittivo del classico grading istologico.
Lo Studio: Mettere alla Prova S100A7
Proprio per approfondire questo aspetto, è stato condotto uno studio retrospettivo (cioè guardando indietro a casi già avvenuti) molto interessante. L’obiettivo era chiaro: valutare l’espressione di S100A7 in lesioni OPMD che si sapeva già essersi trasformate in cancro e confrontare i risultati con i sistemi di grading tradizionali (a 3 e 2 livelli) e con un nuovo sistema basato proprio su S100A7, chiamato S100A7 ARS (Algorithm-based Risk Score).
Per farlo, sono stati selezionati campioni di tessuto (inclusi in paraffina, come si fa di routine nei laboratori di anatomia patologica) di 48 pazienti le cui lesioni OPMD si erano trasformate in OSCC. Come gruppi di controllo, sono stati inclusi 35 pazienti con displasie multiple che però *non* si erano trasformate (con almeno 5 anni di follow-up) e 25 casi di mucosa orale normale o con semplice ipercheratosi (un ispessimento superficiale).
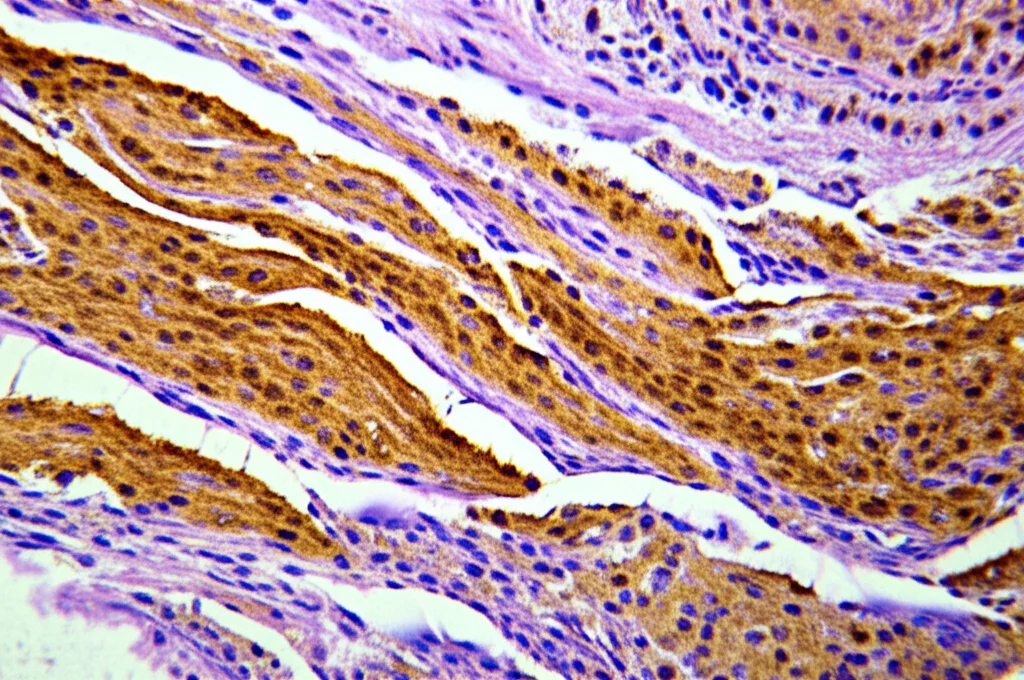
Su tutti questi campioni è stata effettuata una colorazione speciale, l’immunoistochimica (IHC), per visualizzare la proteina S100A7. L’espressione è stata valutata in due modi:
- Semi-quantitativamente (S100A7 IRS – Immunoreactive Score): Assegnando un punteggio basato sull’intensità della colorazione (da 0 a 3) e sulla percentuale di cellule colorate (da 0 a 5), per un punteggio totale massimo di 8. Si è anche guardato dove si trovava la proteina (strati superficiali, basali, ecc.).
- Analisi d’immagine per l’S100A7 ARS: Utilizzando un software specifico (Visiopharm VIS) su immagini digitalizzate dei vetrini, applicando un algoritmo che quantifica l’espressione di S100A7 e caratteristiche citomorfometriche per calcolare un punteggio di rischio di trasformazione a 5 anni (Basso rischio: <19%; Medio rischio: 19%-60%; Alto rischio: >61%).
I Risultati: Cosa Ci Dice S100A7?
Ebbene, i risultati sono stati davvero incoraggianti!
Innanzitutto, si è visto che il punteggio semi-quantitativo (S100A7 IRS) era ben correlato con l’algoritmo ARS. Questo punteggio IRS si è dimostrato utile per distinguere le lesioni OPMD (sia quelle trasformate che quelle non trasformate) dalla mucosa normale di controllo. Tuttavia, *non* riusciva a differenziare in modo statisticamente significativo le lesioni che avrebbero trasformato da quelle che non lo avrebbero fatto.
Qui entra in gioco la potenza dell’S100A7 ARS. Questo sistema algoritmico, più sofisticato, è stato in grado di fare ciò che il grading tradizionale e l’IRS da solo non riuscivano a fare con la stessa efficacia: distinguere le lesioni OPMD destinate a trasformarsi in cancro da quelle che non lo avrebbero fatto (con una differenza statisticamente significativa, p < 0.05). Analizzando i dati più nel dettaglio:
- Il grading a 3 livelli distingueva i controlli dalle displasie, ma non le displasie trasformanti da quelle non trasformanti.
- Il grading a 2 livelli è risultato leggermente migliore, riuscendo a differenziare statisticamente tutti e tre i gruppi (Controlli, Non-Trasformanti, Trasformanti).
- L’S100A7 IRS, come detto, separava bene i controlli dalle displasie, ma non i due gruppi di displasie tra loro.
- L’S100A7 ARS ha mostrato una chiara tendenza all’aumento del rischio percentuale passando dai controlli (media 31%), ai non-trasformanti (media 37%), fino ai trasformanti (media 58.7%). La differenza tra il gruppo trasformante e gli altri due era statisticamente significativa. È interessante notare che nel gruppo trasformante, nessun caso è stato classificato come a basso rischio dall’ARS, ma erano equamente divisi tra medio e alto rischio.
Un altro dato curioso: la correlazione tra i sistemi di grading (2 e 3 livelli) e l’S100A7 ARS era da debole a moderata nel complesso, ma diventava praticamente trascurabile se si considerava solo il gruppo delle lesioni trasformanti. Questo suggerisce che l’ARS sta catturando informazioni sul rischio che vanno oltre quelle valutate dal semplice grading morfologico.
Implicazioni Cliniche: Verso una Gestione Personalizzata
Cosa significa tutto questo per noi e per i pazienti? Moltissimo! Avere un biomarcatore come S100A7, specialmente se valutato con un sistema robusto come l’ARS, potrebbe rivoluzionare la gestione delle OPMD.
Pensateci: oggi, una diagnosi di displasia, anche lieve, spesso porta a controlli clinici frequenti (ogni 3-12 mesi), anche se sappiamo che meno della metà di queste lesioni diventerà cancro. D’altro canto, alcune lesioni considerate non displastiche o a basso rischio possono trasformarsi, sfuggendo magari a una sorveglianza stretta. Questo approccio “taglia unica” non è ideale.
L’S100A7 ARS potrebbe permettere un approccio più personalizzato:
- Identificare i pazienti con lesioni ad alto rischio reale di trasformazione, indipendentemente dal grado di displasia visto al microscopio, permettendo una sorveglianza più intensa o interventi più precoci.
- Rassicurare i pazienti con lesioni a basso rischio (confermato dall’ARS), magari riducendo la frequenza dei controlli e l’ansia associata.
- Potenzialmente, identificare lesioni “a rischio nascosto” che apparirebbero innocue all’esame istologico tradizionale ma che mostrano già alterazioni molecolari rilevate da S100A7.
L’S100A7 IRS, pur meno potente nel distinguere tra trasformanti e non-trasformanti, potrebbe comunque aggiungere informazioni utili. Se una lesione, magari classificata come lieve displasia o addirittura non-OPMD, mostra un IRS elevato (diciamo, >5 secondo questo studio), potrebbe essere un campanello d’allarme per tenerla d’occhio più attentamente. È un test relativamente semplice ed economico da aggiungere all’analisi di routine.
Limiti e Prospettive Future
Come ogni studio, anche questo ha delle limitazioni. Si tratta di uno studio retrospettivo, le informazioni su fattori di rischio come fumo e alcol non erano complete per tutti i casi, e il follow-up di 5 anni potrebbe non essere sufficiente per catturare trasformazioni molto tardive. Inoltre, c’è sempre la possibilità di un bias di campionamento (la biopsia potrebbe non aver colto l’area peggiore della lesione).
Tuttavia, i risultati sono decisamente promettenti. L’S100A7 si conferma un biomarcatore di grande interesse. L’algoritmo ARS, in particolare, sembra uno strumento potente per stratificare il rischio in modo più accurato rispetto ai metodi attuali. Serviranno ovviamente ulteriori studi, magari prospettici (seguendo i pazienti nel tempo) e su coorti più ampie, per validare questi risultati e definire con precisione come integrare questo strumento nella pratica clinica.
Ma la strada sembra tracciata: la biologia molecolare ci sta offrendo strumenti sempre più raffinati per capire e anticipare le mosse del cancro. E S100A7 potrebbe davvero diventare una nostra preziosa alleata nella lotta contro il cancro orale. Staremo a vedere!
Fonte: Springer