EZH2 Sotto Tiro: Come l’Ossido Nitrico Rimodella l’Epigenetica e Mantiene Sane le Nostre Arterie!
Ciao a tutti, appassionati di scienza e curiosi! Oggi voglio portarvi con me in un viaggio affascinante nel mondo microscopico delle nostre cellule, in particolare quelle che rivestono i nostri vasi sanguigni, le cellule endoteliali. Parleremo di come una molecola piccolissima ma potentissima, l’ossido nitrico (NO), giochi un ruolo da protagonista nel mantenere tutto in equilibrio, agendo su un attore chiave della regolazione genica: la proteina EZH2. Sembra complicato? Tranquilli, lo sviscereremo insieme in modo semplice e, spero, intrigante!
Ma chi è questo EZH2 e cosa c’entra con i nostri geni?
Immaginate il nostro DNA come un’immensa biblioteca di istruzioni. Non tutte le istruzioni servono sempre, alcune devono essere “silenziate” o messe in pausa. Qui entra in gioco EZH2. È la componente principale di un complesso proteico chiamato PRC2 (Polycomb Repressive Complex 2). Pensate a PRC2 come a una squadra di “bibliotecari molecolari” specializzati nel mettere dei “segnalibri” specifici su alcuni “libri” (geni) per indicare che non devono essere letti in quel momento.
Il segnalibro preferito di EZH2 si chiama H3K27me3: in pratica, aggiunge dei piccoli gruppi chimici (metilici) a una specifica proteina (l’istone H3) che impacchetta il DNA. Questo marchio H3K27me3 è un segnale quasi universale di “silenzio, non leggere questo gene!”. È fondamentale durante lo sviluppo, per decidere cosa diventerà una cellula, ma anche in età adulta. Quando EZH2 non funziona a dovere, possono insorgere problemi seri, inclusi alcuni tipi di cancro.
La sua attività è finemente regolata da varie modifiche chimiche che la proteina stessa può subire, come l’aggiunta di fosfati (fosforilazione) o zuccheri (O-GlcNAcilazione). Ma fino ad ora, nessuno aveva esplorato a fondo un’altra possibile modifica: la S-nitrosilazione.
L’Ossido Nitrico (NO): Un Messaggero Versatile con un Nuovo Bersaglio
L’ossido nitrico (NO) è una molecola gassosa incredibilmente versatile. Nel nostro corpo fa tantissime cose, dalla regolazione della pressione sanguigna alla difesa immunitaria. Le cellule endoteliali, quelle che rivestono l’interno dei vasi, sono maestre nel produrre NO grazie a un enzima specifico chiamato eNOS (endothelial Nitric Oxide Synthase).
Uno dei modi in cui NO agisce è proprio la S-nitrosilazione: si lega a specifici “mattoncini” delle proteine chiamati residui di cisteina. È come se NO mettesse un piccolo “post-it” chimico sulla proteina, cambiandone il comportamento, la stabilità o la posizione nella cellula.
E qui arriva la nostra scoperta: abbiamo visto che l’NO, sia quello prodotto dalle cellule stesse (attivando eNOS con stimoli come la bradichinina o il VEGF) sia quello fornito dall’esterno (usando molecole come SNP o GSNO), può S-nitrosilare EZH2!
Cosa succede a EZH2 quando viene “toccato” dall’NO? Un Effetto Domino!
Quando EZH2 viene S-nitrosilato, succedono un sacco di cose interessanti, quasi a cascata:
- Il complesso PRC2 si sfalda presto: Una proteina fondamentale per l’attività di EZH2, chiamata SUZ12, si stacca molto rapidamente dal complesso PRC2 dopo l’esposizione all’NO (già dopo 30 minuti!). È come se NO desse una spintarella a SUZ12, rompendo l’armonia della squadra.
- L’attività di “silenziatore” cala drasticamente: Senza SUZ12 al suo fianco, EZH2 perde gran parte della sua capacità di aggiungere i segnalibri H3K27me3. Infatti, abbiamo osservato una riduzione significativa di H3K27me3 già dopo 1 ora dal trattamento con NO, molto prima che EZH2 stesso scompaia.
- EZH2 viene “sfrattato” dal nucleo: EZH2, che normalmente lavora nel nucleo della cellula dove c’è il DNA, viene spinto fuori, nel citoplasma. Lo abbiamo visto sia separando le componenti cellulari sia con immagini al microscopio a fluorescenza. A volte, lo abbiamo persino visto associarsi brevemente alle strutture del citoscheletro (actina).
- Destinazione finale: degradazione: Una volta nel citoplasma, EZH2 S-nitrosilato viene “etichettato” con un’altra molecola chiamata ubiquitina. Questo è il segnale per la cellula di “smaltire” la proteina. Abbiamo scoperto che questo smaltimento avviene principalmente attraverso un sistema chiamato “autofagosoma-lisosoma”, una sorta di impianto di riciclaggio cellulare, anche se pure il proteasoma (un altro sistema di smaltimento) può contribuire. Bloccando entrambi questi sistemi, riuscivamo a impedire la degradazione di EZH2 indotta da NO.
È importante notare che, anche se bloccavamo la degradazione e EZH2 si accumulava (soprattutto nel citoplasma), i livelli di H3K27me3 non tornavano normali. Questo ci dice che l’EZH2 S-nitrosilato, anche se presente, non è più funzionale come prima. L’NO non solo ne causa la degradazione, ma ne “spegne” proprio l’attività catalitica!

Abbiamo Trovato i Punti Esatti: le Cisteine Cruciali!
Ma dove si attacca esattamente l’NO su EZH2? Usando strumenti di predizione al computer e poi verificando in laboratorio, abbiamo identificato tre possibili siti di S-nitrosilazione su residui di cisteina specifici: C260, C329 e C700.
Per capire il ruolo di ciascuno, abbiamo fatto i “detective molecolari”: abbiamo creato delle versioni mutate di EZH2 in cui queste cisteine erano sostituite con un altro amminoacido (serina), rendendole insensibili all’S-nitrosilazione in quel punto. Ecco cosa abbiamo scoperto:
- La mutazione C329S rendeva EZH2 resistente alla degradazione e alla traslocazione nel citoplasma indotte da NO, ma la sua attività catalitica (e quindi i livelli di H3K27me3) veniva comunque ridotta.
- La mutazione C700S, invece, non impediva la degradazione di EZH2, ma ne preservava l’attività catalitica! I livelli di H3K27me3 non calavano nonostante l’esposizione a NO.
- Creando un doppio mutante C329S C700S, abbiamo ottenuto un EZH2 quasi completamente “immune” agli effetti dell’NO: non veniva degradato, non si spostava nel citoplasma, manteneva la sua attività e, cosa fondamentale, SUZ12 non si staccava più dopo il trattamento con NO!
Questo ci dice che l’S-nitrosilazione alla cisteina 329 è la chiave per la stabilità e la localizzazione di EZH2, mentre quella alla cisteina 700 (che si trova proprio nel dominio catalitico della proteina) è cruciale per la sua funzione enzimatica e l’interazione con SUZ12.
Per capire ancora meglio come l’S-nitrosilazione influenzi l’interazione tra EZH2 e SUZ12, abbiamo usato potenti simulazioni al computer (dinamica molecolare). Queste simulazioni ci hanno mostrato che l’aggiunta dei gruppi S-NO alle cisteine 329 e 700 provoca un cambiamento conformazionale in una regione di EZH2 chiamata dominio SAL, che è importante per legare SUZ12. Questo cambiamento indebolisce il legame, spiegando perché SUZ12 si stacca così facilmente quando EZH2 è S-nitrosilato.

Ma a Cosa Serve Tutto Questo? Funzioni Fisiologiche e Potenziali Terapie
Ok, abbiamo capito il meccanismo molecolare, ma qual è il significato biologico di tutto ciò? Beh, è importantissimo per le nostre cellule endoteliali!
L’NO è noto per promuovere la migrazione delle cellule endoteliali, un processo fondamentale per la riparazione dei vasi e la formazione di nuovi (angiogenesi). Abbiamo visto che trattando le cellule con NO (o con inibitori di EZH2, o silenziando EZH2 con siRNA) la migrazione aumentava. Ma se impedivamo la riduzione di H3K27me3 (usando un inibitore delle demetilasi, gli enzimi che rimuovono i gruppi metilici), l’effetto pro-migratorio dell’NO veniva annullato! Questo suggerisce che la regolazione dell’asse EZH2-H3K27me3 da parte dell’NO è cruciale per questo processo.
Inoltre, la riduzione di H3K27me3 porta all’attivazione di geni che normalmente sarebbero silenziati. Abbiamo visto che l’esposizione all’NO aumentava l’espressione di geni importanti per la funzione endoteliale come VEGFa, TBX20, MMP2, FGF2 e Angiopoietin-2. Questo effetto era mediato dalla perdita di H3K27me3 sui loro promotori (le regioni di DNA che ne controllano l’accensione) e veniva bloccato se si impediva la riduzione di H3K27me3.
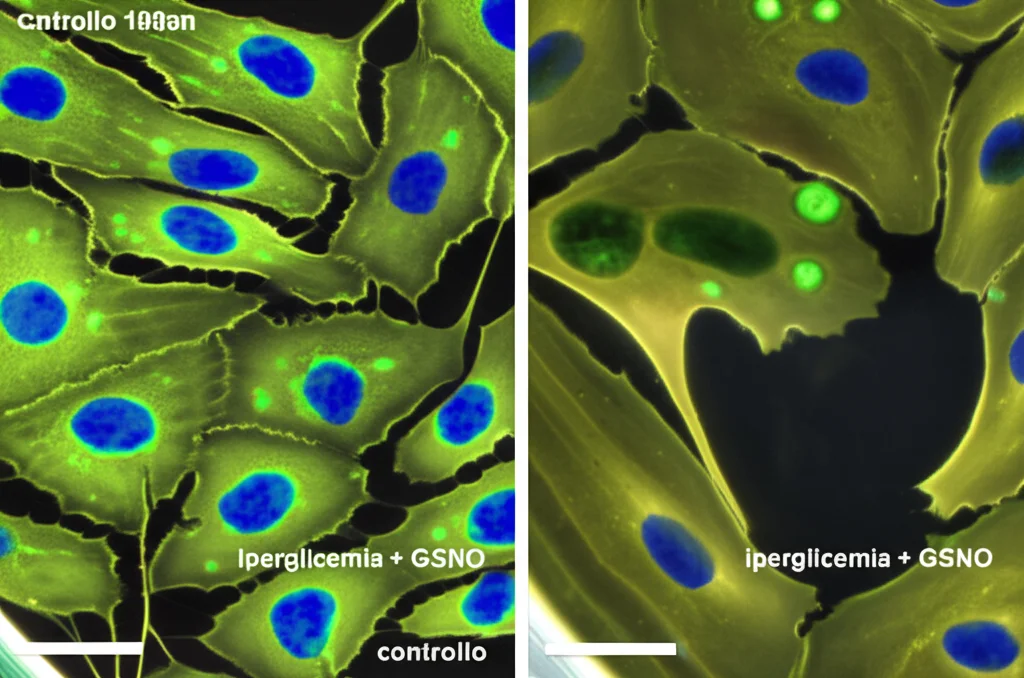
E qui la cosa si fa super interessante per la salute. In condizioni patologiche come l’iperglicemia (alti livelli di zucchero nel sangue, come nel diabete), spesso si osserva una riduzione della produzione di NO da parte delle cellule endoteliali e, contemporaneamente, un aumento patologico dell’attività di EZH2 e dei livelli di H3K27me3. Questo contribuisce all’infiammazione vascolare e alla disfunzione endoteliale.
Noi abbiamo simulato questa condizione in laboratorio e abbiamo visto che, fornendo NO dall’esterno (con GSNO), potevamo:
- Normalizzare i livelli elevati di EZH2 e H3K27me3 indotti dall’iperglicemia.
- Ridurre l’espressione di molecole infiammatorie come ICAM1.
- Diminuire l’adesione dei monociti (un tipo di globulo bianco) alle cellule endoteliali, un evento chiave nell’aterosclerosi.
Abbiamo confermato questi risultati anche usando piccoli pezzi di aorta di ratto in coltura (ex vivo) e analizzando tessuto renale da ratti diabetici, dove abbiamo trovato bassi livelli di NO attivo e alti livelli di EZH2/H3K27me3.
Questo suggerisce che la S-nitrosilazione di EZH2 potrebbe essere un meccanismo protettivo endogeno e che “riattivarlo”, magari fornendo NO, potrebbe rappresentare una nuova strategia terapeutica per contrastare le complicanze vascolari del diabete e altre condizioni infiammatorie.
In Conclusione: Un Nuovo Capitolo nell’Epigenetica Endoteliale
Insomma, ragazzi, quello che abbiamo scoperto è un meccanismo nuovo e affascinante attraverso cui l’ossido nitrico, un messaggero cellulare fondamentale, “parla” direttamente con il macchinario epigenetico della cellula, modulando l’attività di EZH2 e del complesso PRC2.
La S-nitrosilazione di EZH2 alle cisteine C329 e C700 emerge come un interruttore molecolare critico che ne controlla la stabilità, la localizzazione e la funzione, influenzando l’espressione genica, la migrazione cellulare e l’omeostasi endoteliale. Non solo ci aiuta a capire meglio come funzionano le nostre cellule in condizioni normali, ma apre anche prospettive intriganti per lo sviluppo di nuove terapie mirate a riequilibrare la funzione endoteliale in malattie come il diabete.
È la dimostrazione di come anche le modifiche più piccole a livello molecolare possano avere conseguenze enormi per la nostra salute. La ricerca non si ferma qui, ovviamente, ma spero di avervi trasmesso un po’ dell’entusiasmo per questa scoperta! Alla prossima!
Fonte: Springer