Parkinson: Svelato il Ruolo Chiave dell’Infiammazione Cerebrale (e Come Fermarla?)
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi appassiona moltissimo e che riguarda una malattia che, purtroppo, conosciamo bene: il Parkinson. Sapete, il Parkinson è una bestia complessa, una malattia neurodegenerativa legata all’età che non si limita a causare problemi motori, ma impatta pesantemente sulla qualità della vita con tanti sintomi diversi. Al cuore del problema c’è la perdita progressiva di neuroni speciali, quelli che producono dopamina, in un’area specifica del cervello chiamata substantia nigra compacta (SNc). Ma perché muoiono questi neuroni?
Il Mistero dell’Infiammazione nel Parkinson
Da tempo sospettiamo che la neuroinfiammazione, un’infiammazione specifica del sistema nervoso, giochi un ruolo da protagonista. Pensate al cervello come a una città super complessa e delicata. L’infiammazione, in condizioni normali, è come una squadra di pronto intervento che arriva per riparare i danni o eliminare intrusi. Ma a volte, questa squadra può diventare iperattiva, quasi fuori controllo, e iniziare a fare più danni che altro. Nel Parkinson, sembra succedere proprio questo. Cellule immunitarie come microglia e astrociti si attivano, rilasciando sostanze infiammatorie (citochine come TNF-α, IL-1β, IL-6) che, invece di proteggere, finiscono per accelerare la morte dei preziosi neuroni dopaminergici.
Il problema è che, finora, non avevamo un quadro chiarissimo di *come* questa infiammazione si manifesti nelle diverse cellule cerebrali e quali siano i meccanismi precisi che la scatenano nel contesto del Parkinson. È qui che entra in gioco la potenza delle nuove tecnologie!
Un Tuffo nel Cervello: Cosa Dicono le Cellule una per Una?
Per vederci più chiaro, abbiamo deciso di fare un’analisi super dettagliata. Immaginate di poter “intervistare” migliaia di singole cellule provenienti dal cervello di pazienti con Parkinson e confrontarle con quelle di persone sane. È quello che abbiamo fatto usando dati di sequenziamento a singola cellula (scRNA-seq) e dati di trascrittoma (microarray) provenienti dal mesencefalo e dalla substantia nigra di pazienti, disponibili pubblicamente nel database GEO (Gene Expression Omnibus). È come avere una mappa incredibilmente dettagliata di cosa succede a livello molecolare, cellula per cellula.
Abbiamo analizzato decine di migliaia di cellule (oltre 39.000 dal mesencefalo e quasi 58.000 dalla substantia nigra!) e le abbiamo raggruppate in base al loro “mestiere”: neuroni (eccitatori, inibitori, dopaminergici), oligodendrociti, astrociti, cellule immunitarie come la microglia, e altre ancora.
Microglia Sotto i Riflettori: I ‘Guardiani’ Infiammati
La prima cosa che è saltata all’occhio? Nel cervello dei pazienti con Parkinson, la proporzione di microglia era significativamente aumentata rispetto ai controlli sani, sia nel mesencefalo che nella substantia nigra. Non solo: analizzando quali “programmi” genetici fossero attivi, abbiamo visto che proprio la microglia mostrava i livelli più alti di attività infiammatoria. Usando diverse tecniche computazionali (GSVA, AddModuleScore, UCell, AUCell), la microglia è risultata costantemente la popolazione cellulare con il punteggio di “risposta infiammatoria” più elevato. Insomma, sembrano essere proprio loro, le cellule sentinella del cervello, a guidare la carica infiammatoria nel Parkinson.
Abbiamo anche confermato questi dati analizzando dataset di microarray più “tradizionali” (GSE7621 e GSE49036), che hanno mostrato una chiara attivazione di percorsi legati all’infiammazione (come le vie di segnalazione TNFα/NF-κB, JAK-STAT, interferone) e una riduzione del gene TH (tirosina idrossilasi), fondamentale per produrre dopamina, nei pazienti con Parkinson.
Non Tutta la Microglia è Uguale: Identikit dei Sottotipi
Ma la storia si fa ancora più interessante. La microglia non è un blocco monolitico. Andando ad analizzare più a fondo le quasi 4000 cellule microgliali identificate, abbiamo scoperto che si potevano dividere in almeno quattro sottogruppi distinti (che abbiamo chiamato Microglia 0, 1, 2 e 3). E qui la sorpresa: nei pazienti con Parkinson, le proporzioni di Microglia 1 e Microglia 2 erano significativamente aumentate, mentre Microglia 0 e 3 erano ridotte.
Analizzando le funzioni di questi sottotipi, è emerso che Microglia 1 era quella con i punteggi più alti per i percorsi infiammatori (come IL-6/JAK/STAT3, TNF-α via NF-κB). Non solo, esprimeva alti livelli di geni associati alle cosiddette “Disease-Associated Microglia” (DAM), un tipo di microglia attivata trovata anche nell’Alzheimer (geni come APOE, SPP1, TREM2). Al contrario, Microglia 0 e 3 sembravano più legate a uno stato “normale” o di riposo.
Usando un’analisi di “traiettoria”, abbiamo ricostruito il possibile percorso evolutivo di queste cellule. Sembra che la microglia parta da uno stato più quiescente (simile a Microglia 3) e possa evolvere verso stati diversi, con Microglia 1 che rappresenta uno stato finale pro-infiammatorio, arricchito in funzioni come la presentazione dell’antigene e la fagocitosi (efferocitosi), ma anche la ferroptosi (un tipo di morte cellulare).
Il Regista dell’Infiammazione: Ecco STAT3!
A questo punto, la domanda era: chi dirige questa trasformazione verso lo stato infiammatorio? Chi è il “regista” molecolare? Utilizzando un’analisi chiamata SCENIC, che cerca di identificare i fattori di trascrizione chiave (proteine che accendono o spengono i geni), abbiamo trovato un candidato principale per Microglia 1: STAT3. Questo fattore di trascrizione mostrava l’attività più alta proprio in questo sottotipo microgliale pro-infiammatorio.
STAT3 fa parte di una famiglia di proteine che trasducono segnali dall’esterno della cellula al nucleo, attivando la trascrizione di geni specifici, spesso in risposta a citochine infiammatorie come IL-6 o interferoni. Abbiamo visto che l’attività del “regulon” di STAT3 (l’insieme dei geni controllati da STAT3) era significativamente più alta nei pazienti con Parkinson rispetto ai controlli. Inoltre, c’era una forte correlazione positiva tra l’attività del regulon STAT3 e i punteggi di risposta infiammatoria, sia nei nostri dati che in altri dataset cerebrali (GTEx). Sembrava proprio che STAT3 fosse un ingranaggio cruciale nella macchina infiammatoria microgliale del Parkinson.
La Prova del Nove: Il Modello Animale Conferma
Ok, i dati umani erano intriganti, ma serviva una conferma sperimentale. Siamo passati quindi a un modello animale di Parkinson, inducendo la malattia in topi tramite la somministrazione cronica di una tossina chiamata MPTP. Questi topi sviluppano sintomi simili al Parkinson umano:
- Difficoltà motorie (meno distanza percorsa nell’open field test, minor tempo sul rotarod, più tempo per scendere da un palo).
- Perdita di neuroni dopaminergici (cellule TH-positive) nella substantia nigra.
E cosa abbiamo trovato nel cervello di questi topi? Esattamente quello che ci aspettavamo sulla base dei dati umani!
- Aumento dei marcatori infiammatori (IL-6, TNF-α, IL-1β).
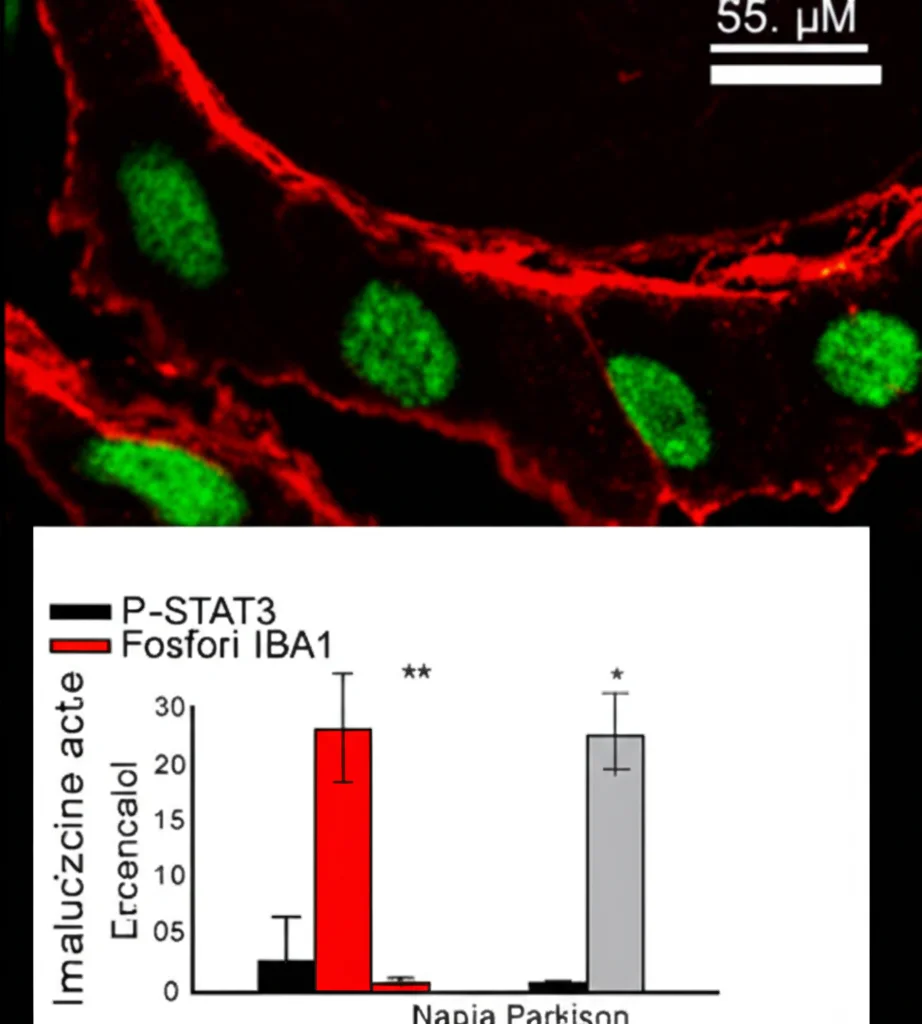
- Aumento significativo dei livelli di STAT3 fosforilato (P-STAT3), che è la forma attiva di STAT3.
- Aumento del numero di microglia attivate (marcate con IBA1), con corpi cellulari più grandi e meno ramificazioni (segno di attivazione).
- Una chiara co-localizzazione: molte delle microglia attivate (IBA1+) esprimevano alti livelli di P-STAT3.
La connessione tra attivazione microgliale, infiammazione e STAT3 nel modello animale era evidente.
In Laboratorio: Bloccare STAT3 Protegge i Neuroni?
L’ultimo passo era capire se intervenire su STAT3 potesse avere un effetto protettivo. Abbiamo usato cellule microgliali BV2 in coltura e le abbiamo trattate con MPP+, il metabolita tossico dell’MPTP, per simulare l’infiammazione. Come previsto, le cellule BV2 trattate con MPP+ producevano più citochine infiammatorie (IL-6, TNF-α, IL-1β) e mostravano livelli più alti di P-STAT3.
Poi abbiamo aggiunto Stattic, un farmaco che inibisce specificamente la fosforilazione (e quindi l’attivazione) di STAT3. Risultato? Il trattamento con Stattic ha significativamente ridotto la produzione di citochine infiammatorie e i livelli di P-STAT3 nelle cellule BV2 esposte a MPP+.
Ma l’esperimento chiave è stato questo: abbiamo preso il “brodo di coltura” (mezzo condizionato) delle cellule BV2 trattate (controllo, solo MPP+, MPP+ più Stattic) e lo abbiamo usato per coltivare neuroni umani (cellule SH-SY5Y). Il mezzo proveniente dalle cellule infiammate (solo MPP+) causava un aumento della morte neuronale. Ma il mezzo proveniente dalle cellule trattate anche con Stattic era significativamente meno tossico e proteggeva i neuroni dalla morte! Questo dimostra che bloccare l’attivazione di STAT3 nella microglia può ridurre l’infiammazione e avere un effetto neuroprotettivo.
Tiriamo le Somme: Cosa Significa Tutto Questo?
Mettendo insieme tutti i pezzi – analisi su cellule umane, modelli animali, esperimenti in vitro – emerge un quadro coerente: la neuroinfiammazione guidata dalla microglia è un elemento centrale nella patogenesi del Parkinson. All’interno della popolazione microgliale, esiste un sottotipo pro-infiammatorio (che abbiamo chiamato Microglia 1) che aumenta nei pazienti e sembra guidato dall’attivazione del fattore di trascrizione STAT3. L’attivazione di STAT3 porta al rilascio di fattori infiammatori che contribuiscono alla morte dei neuroni dopaminergici. La buona notizia è che inibire STAT3 sembra ridurre questa infiammazione dannosa e proteggere i neuroni.
Certo, ci sono delle limitazioni. I nostri campioni umani non erano enormi, e i modelli animali, per quanto utili, non replicano perfettamente la complessità e la cronicità della malattia umana. Inoltre, STAT3 è coinvolto in molte funzioni cellulari, quindi un’inibizione sistemica potrebbe avere effetti collaterali. Serviranno strategie mirate, magari veicolando farmaci specifici direttamente alla microglia nel cervello.
Ma la strada è tracciata. Aver identificato STAT3 come un nodo cruciale nel processo neuroinfiammatorio del Parkinson apre prospettive terapeutiche davvero interessanti. Modulare la via di segnalazione di STAT3 potrebbe rappresentare una nuova strategia per rallentare o fermare la progressione di questa malattia devastante. È un campo di ricerca in fermento, e spero di potervi raccontare presto nuovi sviluppi!

Fonte: Springer