HOXB8: La Chiave Nascosta nel Carcinoma Testa-Collo? La Nostra Analisi Rivela Tutto!
Ciao a tutti! Oggi voglio parlarvi di un argomento che mi sta particolarmente a cuore e su cui abbiamo lavorato intensamente: il carcinoma a cellule squamose della testa e del collo (HNSCC). Si tratta di un tumore maligno piuttosto comune a livello globale, noto per la sua aggressività e la tendenza a dare metastasi precocemente [1]. Colpisce diverse aree come la cavità nasale, la bocca, la faringe e la gola [2], e sappiamo che fattori come l’abuso di alcol e il fumo di tabacco giocano un ruolo importante nel suo sviluppo [3].
Purtroppo, la diagnosi arriva spesso tardi, quando il tumore è già in fase avanzata, in oltre il 50% dei casi [4]. Le opzioni terapeutiche attuali, come chirurgia, radioterapia e chemioterapia [5], non sono sempre risolutive. Molti pazienti, infatti, vanno incontro a recidive e metastasi dopo il trattamento, con una sopravvivenza a lungo termine ancora insoddisfacente [6].
Ecco perché la ricerca di biomarcatori efficaci è fondamentale. Questi “segnali” biologici potrebbero aiutarci a diagnosticare precocemente la malattia, a valutarne il rischio, a stimare la prognosi e a sviluppare strategie terapeutiche più mirate e personalizzate. Ed è proprio in questo contesto che entra in gioco una proteina chiamata HOXB8 (Homeobox B8).
Alla scoperta di HOXB8: un protagonista inaspettato?
HOXB8 è una proteina già nota per essere coinvolta in diversi processi fisiologici e patologici, inclusi altri tipi di cancro. Ad esempio, è stato osservato che può aumentare la malignità nel cancro ovarico [7], facilitare le metastasi nel cancro gastrico [8], promuovere l’invasione nel cancro del colon [9] e favorire la proliferazione e le metastasi nel cancro al pancreas [10]. Ma quale ruolo gioca specificamente nell’HNSCC? Questa era la domanda a cui volevamo dare una risposta.
Nel nostro studio, abbiamo intrapreso un’analisi completa, combinando dati “multi-omici” (cioè provenienti da diverse discipline come genomica e trascrittomica) disponibili pubblicamente dal database The Cancer Genome Atlas (TCGA) con esperimenti di validazione in laboratorio. E i risultati sono stati davvero illuminanti!
Cosa abbiamo scoperto su HOXB8 nell’HNSCC?
La prima cosa che abbiamo notato analizzando i dati di 522 pazienti con HNSCC e 44 campioni normali è che l’espressione del gene HOXB8 è significativamente più alta nei tessuti tumorali rispetto a quelli sani. Non solo: livelli più alti di HOXB8 sono associati a stadi clinici più avanzati (T3-4 vs T1-2; N1-3 vs N0) e, purtroppo, a una prognosi peggiore per i pazienti in termini di sopravvivenza globale e sopravvivenza libera da progressione.
Abbiamo anche indagato dove si trovasse questa proteina all’interno delle cellule tumorali. Utilizzando tecniche di immunofluorescenza su linee cellulari di HNSCC (SCC-4 e CAL-27), abbiamo visto che HOXB8 si localizza prevalentemente nel nucleoplasma, la parte interna del nucleo cellulare. Questo suggerisce che possa agire regolando l’espressione di altri geni.

HOXB8 al microscopio: conferme sperimentali in vitro e in vivo
Per confermare e approfondire questi dati, siamo passati alla sperimentazione diretta. Innanzitutto, abbiamo misurato i livelli di HOXB8 in diverse linee cellulari: una linea di cellule epiteliali squamose umane normali (NOK) e tre linee cellulari di HNSCC (HN-4, SCC-4, CAL-27). Come sospettavamo, i livelli di RNA e proteina HOXB8 erano più alti nelle cellule tumorali rispetto a quelle normali.
A questo punto, ci siamo chiesti: cosa succede se “spegniamo” HOXB8 nelle cellule tumorali? Abbiamo selezionato le linee SCC-4 e CAL-27 (quelle con i livelli più alti di HOXB8) e abbiamo utilizzato una tecnica chiamata “knockdown” per ridurre l’espressione di HOXB8. I risultati sono stati netti:
- La proliferazione delle cellule tumorali è stata significativamente inibita (verificato con test CCK8, formazione di colonie e test EdU).
- La capacità delle cellule di invadere i tessuti circostanti e di migrare è stata notevolmente ridotta (verificato con test Transwell e wound-healing).
Questi esperimenti in vitro ci hanno dato una forte indicazione che HOXB8 agisce come promotore delle caratteristiche maligne delle cellule HNSCC.
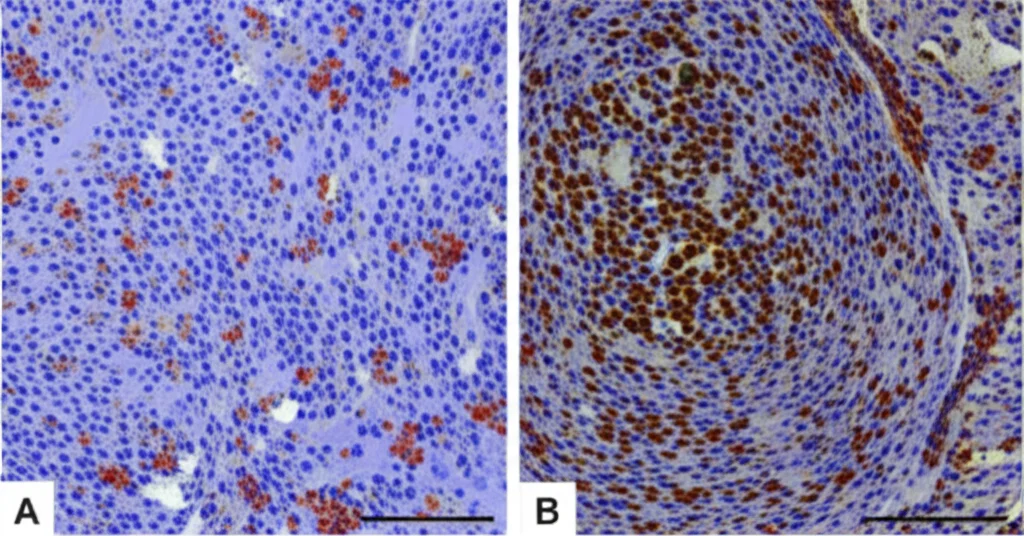
Ma non ci siamo fermati qui. Volevamo vedere se questi effetti si confermavano anche in un organismo vivente (in vivo). Abbiamo quindi condotto esperimenti su topi immunodeficienti (nude mice). Abbiamo iniettato cellule SCC-4 (sia quelle normali, sia quelle con HOXB8 “spento”) sotto la pelle dei topi. Dopo 24 giorni, abbiamo osservato che i tumori formati dalle cellule con HOXB8 ridotto erano significativamente più piccoli e leggeri rispetto a quelli del gruppo di controllo. L’analisi immunoistochimica (IHC) ha confermato una minore proliferazione cellulare (meno cellule positive al marcatore Ki67) nei tumori con HOXB8 ridotto.
In un altro esperimento, abbiamo iniettato le cellule tumorali direttamente nella vena della coda dei topi per simulare la metastasi polmonare. Anche in questo caso, i topi che avevano ricevuto cellule con HOXB8 ridotto presentavano un numero inferiore di focolai tumorali nei polmoni.

Come agisce HOXB8? Le vie molecolari coinvolte
Ok, abbiamo visto che HOXB8 promuove la crescita e la diffusione del tumore. Ma *come* lo fa? Per capirlo, siamo tornati ai dati bioinformatici. Abbiamo confrontato il profilo di espressione genica dei pazienti HNSCC con alti livelli di HOXB8 rispetto a quelli con bassi livelli, identificando i geni espressi differentemente (Differentially Expressed Genes – DEGs).
Analizzando questi DEGs con strumenti bioinformatici come clueGO e Gene Set Enrichment Analysis (GSEA), abbiamo scoperto che HOXB8 sembra influenzare diverse vie biologiche cruciali nel cancro:
- Transizione Epitelio-Mesenchimale (EMT): Un processo cellulare che permette alle cellule tumorali di perdere le loro caratteristiche “statiche” e acquisire capacità migratorie e invasive, fondamentali per la formazione di metastasi.
- Via di segnale PI3K/AKT/mTOR: Una cascata di segnali intracellulari nota per regolare la crescita, la proliferazione, la sopravvivenza e il metabolismo delle cellule. È spesso iperattivata nei tumori.
Abbiamo poi validato questi risultati bioinformatici con esperimenti di Western blot sulle nostre linee cellulari. Ebbene sì: quando abbiamo ridotto HOXB8, abbiamo osservato una significativa soppressione dell’attivazione delle vie PI3K/AKT/mTOR e EMT. Questo ci dà un’idea più chiara dei meccanismi molecolari attraverso cui HOXB8 esercita il suo ruolo pro-tumorale.
HOXB8 e il Microambiente Tumorale: un’influenza nascosta
Il cancro non è solo una questione di cellule tumorali impazzite. È fondamentale anche il contesto in cui crescono, il cosiddetto microambiente tumorale (TME), che include cellule immunitarie, cellule stromali, vasi sanguigni e matrice extracellulare. Abbiamo quindi indagato se HOXB8 potesse influenzare anche il TME nell’HNSCC.
Utilizzando algoritmi bioinformatici (come ESTIMATE, CIBERSORT, EPIC, etc.) per analizzare la composizione cellulare del TME nei campioni di pazienti, abbiamo fatto una scoperta interessante:
- I pazienti con alti livelli di HOXB8 tendono ad avere una minore infiltrazione di linfociti T CD8+. Queste sono cellule immunitarie “killer”, fondamentali per riconoscere ed eliminare le cellule tumorali. Una loro scarsità è generalmente associata a una peggiore risposta immunitaria contro il cancro.
- Al contrario, questi stessi pazienti mostrano una maggiore infiltrazione di macrofagi M2. I macrofagi M2 sono spesso considerati “pro-tumorali”, in quanto possono favorire la crescita del tumore, l’angiogenesi (formazione di nuovi vasi sanguigni) e la soppressione della risposta immunitaria antitumorale.
Questi risultati suggeriscono che HOXB8 non solo agisce direttamente sulle cellule tumorali, ma potrebbe anche “rimodellare” il microambiente circostante per renderlo più favorevole alla progressione del cancro e forse meno reattivo alle terapie immunitarie.
Un Modello Prognostico basato su HOXB8
Visto il forte legame tra HOXB8 e la prognosi dei pazienti HNSCC, abbiamo provato a sfruttare questa informazione per costruire un modello prognostico. L’idea è quella di creare uno “score di rischio” che possa aiutare i medici a prevedere meglio l’andamento della malattia per un singolo paziente.
Abbiamo identificato i geni la cui espressione è correlata a quella di HOXB8. Poi, utilizzando analisi statistiche sofisticate (regressione di Cox univariata, regressione LASSO, regressione di Cox multivariata) sui dati di un gruppo di pazienti (“training cohort”), abbiamo selezionato quattro geni chiave: ADD2, SYT1, PXYLP1, e MRPL33. Combinando i livelli di espressione di questi quattro geni con specifici coefficienti, abbiamo creato una formula per calcolare un “Riskscore”.
Abbiamo testato questo modello sia nel gruppo di training che in un gruppo indipendente di pazienti (“validation cohort”). I risultati sono stati molto incoraggianti: il nostro modello è stato in grado di distinguere efficacemente i pazienti ad alto rischio da quelli a basso rischio, con i pazienti ad alto rischio che mostravano una sopravvivenza significativamente peggiore. Le curve ROC (uno strumento per valutare l’accuratezza di un test diagnostico/prognostico) hanno mostrato una buona performance del modello nel predire la sopravvivenza a 1, 3 e 5 anni.
Conclusioni e Prospettive Future
Il nostro studio getta nuova luce sul ruolo complesso di HOXB8 nel carcinoma a cellule squamose della testa e del collo. Abbiamo dimostrato che è sovraespresso, associato a una prognosi sfavorevole e localizzato nel nucleo. Esperimenti in vitro e in vivo hanno confermato che la sua soppressione frena la proliferazione, l’invasione e la migrazione delle cellule tumorali. Abbiamo identificato le vie PI3K/AKT/mTOR e EMT come meccanismi molecolari chiave e abbiamo scoperto che HOXB8 può influenzare negativamente il microambiente tumorale, riducendo i linfociti T CD8+ “buoni” e aumentando i macrofagi M2 “cattivi”. Infine, abbiamo sviluppato un modello prognostico promettente basato su geni correlati a HOXB8.
Certo, come in ogni ricerca, ci sono delle limitazioni. L’uso di dati bioinformatici e linee cellulari specifiche potrebbe non rappresentare tutta la complessità dell’HNSCC. I nostri esperimenti valutano effetti a breve termine e i modelli animali non replicano perfettamente l’interazione tumore-sistema immunitario umano. Serviranno studi futuri, magari trial clinici prospettici, per validare ulteriormente questi risultati e per capire se HOXB8 possa diventare un bersaglio terapeutico concreto.
Tuttavia, crediamo che il nostro lavoro rappresenti un passo avanti importante nella comprensione di questo tumore e apra nuove strade per la ricerca futura, con la speranza di migliorare la diagnosi e il trattamento per i pazienti affetti da HNSCC.
Fonte: Springer