Zebrafish e Robot: La Microiniezione Automatizzata Rivoluziona la Ricerca sul Cancro!
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta cambiando il modo in cui studiamo il cancro e testiamo nuove terapie. Avete mai sentito parlare dello zebrafish? Questo piccolo pesce tropicale, noto anche come *Danio rerio*, è diventato un protagonista sorprendente nei laboratori di ricerca di tutto il mondo. Perché? Beh, le sue larve hanno delle caratteristiche uniche: sono piccole, si sviluppano rapidamente, sono trasparenti (il che ci permette di vedere letteralmente cosa succede dentro!) e, cosa fondamentale per noi, tollerano bene il trapianto di cellule umane, inclusi quelle tumorali. Questo processo si chiama xenotrapianto.
Perché lo Zebrafish è un Modello Vincente?
Utilizzare le larve di zebrafish per studiare i tumori ci offre vantaggi incredibili rispetto ai modelli tradizionali come le colture cellulari o i mammiferi:
- Velocità: I tumori crescono rapidamente nelle larve, permettendoci di osservare processi come formazione, migrazione e metastasi in pochi giorni.
- Visibilità: Grazie alla loro trasparenza, possiamo seguire le cellule tumorali marcate in tempo reale.
- Efficienza: Servono pochissime cellule tumorali per l’impianto e possiamo lavorare su un gran numero di larve contemporaneamente.
- Versatilità: Abbiamo già testato con successo cellule di vari tipi di cancro: prostata, seno, vescica, colon-retto, glioblastoma e persino tumori pediatrici.
- Potenziale Clinico: I modelli di xenotrapianto da paziente (PDX), in cui si usano cellule tumorali prelevate direttamente dai pazienti, si stanno dimostrando promettenti per predire la risposta individuale ai trattamenti. Immaginate di poter testare l’efficacia di una chemio su un “avatar” del paziente prima di somministrarla!
La Sfida della Microiniezione Manuale
Tutto bellissimo, vero? C’è però un “ma”. Introdurre queste cellule tumorali (o altre sostanze) nelle larve richiede una tecnica chiamata microiniezione. E qui casca l’asino, o meglio, trema la mano! Le larve a 2 giorni dalla fecondazione sono lunghe circa 3.7 mm e larghe 0.6 mm. Dobbiamo iniettare con precisione chirurgica in punti specifici e minuscoli come:
- Il dotto di Cuvier (DoC): per immettere le cellule direttamente nel flusso sanguigno e studiare la metastasi.
- Lo spazio perivitellino (PVS): un’area senza vasi sanguigni, ideale per studiare la formazione di nuovi vasi (angiogenesi) e la migrazione locale.
- Il ventricolo del romboencefalo: per studiare i tumori cerebrali.
Farlo manualmente richiede una mano fermissima, anni di pratica, tanta pazienza e strumenti specifici (microscopio, microiniettore, micromanipolatore). È un processo lento, faticoso e, diciamocelo, i risultati possono variare molto da un operatore all’altro. Questa variabilità e la bassa produttività limitano l’uso su larga scala degli xenotrapianti di zebrafish, specialmente per lo screening rapido di farmaci o per applicazioni diagnostiche cliniche.

L’Innovazione: Il Robot per la Microiniezione Automatizzata!
Ed è qui che entriamo in gioco noi (parlo a nome della comunità scientifica che lavora su queste frontiere!). Per superare queste difficoltà, abbiamo progettato, costruito e validato un robot per la microiniezione automatizzata. Sì, avete capito bene, un robot che fa il lavoro sporco (e delicatissimo) per noi!
Questo sistema è un concentrato di tecnologia:
- Visione Superiore: Una telecamera ad alta risoluzione con una lente telecentrica speciale e messa a fuoco liquida (sì, liquida!) ci permette di vedere i dettagli dall’alto.
- Visione Inferiore: Un’altra telecamera con lente telecentrica aiuta a localizzare le larve sulla piastra.
- Illuminazione Intelligente: Luci speciali (a cupola e coassiale) migliorano la messa a fuoco sulla superficie o permettono di vedere strutture complesse come il flusso sanguigno.
- Ago Rotante: L’ago è montato su un supporto che può ruotare, adattandosi all’orientamento della larva, invece di dover spostare la larva per allinearla all’ago. Geniale, no?
- Controllo Touchscreen: Un’interfaccia intuitiva per gestire tutto il processo.
- Intelligenza Artificiale: Il cuore del sistema! Abbiamo “addestrato” il robot usando migliaia di immagini annotate di larve e dei siti di iniezione (DoC, PVS, romboencefalo). Ora il robot riconosce automaticamente le larve sulla piastra, ne capisce l’orientamento e posiziona l’ago nel punto esatto.
Come Funziona in Pratica?
Il processo è stato ottimizzato in cinque passaggi:
- Impostazioni: Si sceglie lo stadio di sviluppo della larva, il sito di iniezione, l’angolo dell’ago e la “macro” di iniezione (la sequenza di azioni).
- Calibrazione Ago: Si assicura che l’ago sia all’altezza giusta e che il punto di iniezione sia corretto per ogni rotazione.
- Calibrazione Goccia: Si misura automaticamente il volume della goccia iniettata per garantire la giusta dose.
- Selezione Piastra: Si inserisce la piastra di agarosio con le larve anestetizzate (distribuite a caso, non serve allinearle!).
- Iniezione: Si preme “Start”!
Il robot può operare in due modalità:
- Modalità Completamente Automatica: Il robot fa tutto da solo: scansiona la piastra, trova una larva, si posiziona, esegue la macro di iniezione e passa alla successiva. Velocissimo!
- Modalità Semi-Automatica: Il robot posiziona la larva e naviga fino al sito, ma l’operatore mantiene il controllo finale sull’iniezione tramite touchscreen. Utile per sviluppare nuove procedure o per situazioni particolari.
Una delle sfide più grandi era iniettare cellule vive, che sono più grandi, tendono a depositarsi, ad aggregarsi e possono ostruire l’ago. Il robot gestisce anche questo, ad esempio permettendo iniezioni multiple di piccole gocce per raggiungere il volume desiderato o rilevando la perforazione della pelle monitorando piccoli movimenti dei tessuti.

Validazione su Larga Scala: La Prova del Nove
Non ci siamo accontentati di testarlo nel nostro laboratorio. Abbiamo coinvolto un consorzio europeo (progetto ROBO-FISH) con partner in Svezia (Bioreperia), Norvegia (NCMM), Paesi Bassi (LSM, LUMC) e Spagna (ZeClinics). In questi laboratori indipendenti, diversi operatori hanno testato il robot iniettando varie sostanze:
- Coloranti (blu tripano, destrano, rosso fenolo)
- Linfociti infiltranti il tumore (TILs)
- Cellule tumorali umane (cancro alla vescica UM-UC-3, cancro al seno MDA-MB-231, glioblastoma SU-DIPG-XIII-P*, campioni clinici da pazienti)
- Microsfere
Abbiamo confrontato i risultati del robot (sia in modalità automatica che semi-automatica) con quelli ottenuti da ricercatori esperti che usavano il metodo manuale tradizionale.
Risultati Entusiasmanti!
I dati parlano chiaro:
- Tasso di Successo: In media, il robot ha raggiunto un tasso di successo dell’iniezione di circa il 60%, assolutamente paragonabile (e in alcuni casi superiore) ai metodi manuali (media 56-63% a seconda del sito).
- Sopravvivenza delle Larve: La sopravvivenza delle larve dopo l’iniezione ha superato il 70%, anche qui in linea con le tecniche manuali.
- Velocità: Ecco il vero punto di svolta! La modalità completamente automatica del robot è risultata, in media, due volte più veloce del metodo manuale (es. 43 secondi per larva contro 84 secondi nel DoC; 120 larve/ora contro 57-60 larve/ora nel romboencefalo).
- Riproducibilità e Accessibilità: Il robot riduce drasticamente la variabilità legata all’abilità dell’operatore e richiede solo poche ore di training rispetto agli anni necessari per diventare esperti manualmente. Questo rende la tecnica accessibile a molti più laboratori, anche quelli senza esperienza pregressa con lo zebrafish.
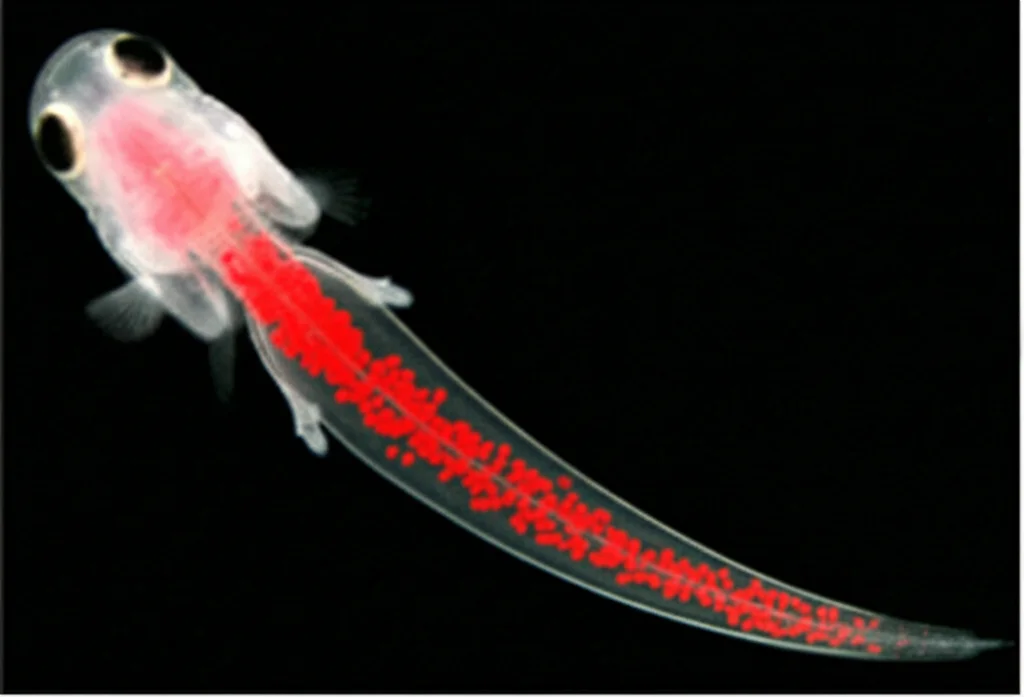
Implicazioni e Futuro: Verso la Medicina Personalizzata
Cosa significa tutto questo? Significa poter accelerare enormemente la ricerca sul cancro. Possiamo testare più farmaci, più velocemente e con risultati più affidabili. Possiamo studiare meglio i meccanismi di crescita e diffusione dei tumori.
Ma l’orizzonte è ancora più ampio. Studi clinici retrospettivi hanno mostrato una correlazione molto alta (fino al 91%!) tra il comportamento del tumore di un paziente nello zebrafish e la sua risposta reale alle terapie standard. L’automazione apre la strada all’uso di questi modelli zebrafish-PDX come strumenti diagnostici nei laboratori ospedalieri, per una medicina di precisione davvero funzionale e personalizzata. Immaginate un futuro in cui, prima di iniziare una terapia pesante, si possa testare la sua efficacia sull’ “avatar” zebrafish del paziente, scegliendo così il trattamento più promettente e riducendo sofferenze e costi.
Il nostro robot è versatile e stiamo già lavorando per automatizzare le iniezioni in altri siti (vena caudale, vescica natatoria, spazio pericardico) e per adattarlo ad altre applicazioni (malattie infettive, screening di composti, tossicologia) e persino ad altre specie (come le zanzare per la ricerca sulla malaria!).
In conclusione, l’unione tra la biologia dello zebrafish e la robotica avanzata sta aprendo scenari incredibili. Questa tecnologia non solo semplifica un compito complesso, ma aumenta la produttività e l’affidabilità, promettendo di accelerare la scoperta di nuove cure e di rendere la medicina personalizzata una realtà più vicina per molti pazienti oncologici. È un momento davvero emozionante per la ricerca!
Fonte: Springer