Apnea Notturna e Fegato: Svelato il Ruolo Segreto degli RNA Circolari!
Ciao a tutti! Oggi voglio parlarvi di qualcosa di veramente affascinante che sta emergendo nel campo della ricerca medica, un argomento che collega due cose apparentemente distanti: il sonno disturbato e la salute del nostro fegato. Nello specifico, ci tufferemo nel mondo microscopico degli RNA circolari (circRNA) e del loro possibile ruolo nel danno epatico causato dall’Apnea Ostruttiva del Sonno (AOS).
Sapete, l’AOS è quel disturbo fastidioso in cui le vie aeree si chiudono ripetutamente durante il sonno, causando cali di ossigeno nel sangue e un sonno frammentato. Questo stato viene chiamato Ipossia Intermittente Cronica (IIC). Oltre ai ben noti problemi cardiovascolari e neurocognitivi, stiamo scoprendo che l’AOS può mettere a dura prova anche il nostro fegato. Come? Attraverso meccanismi complessi come stress ossidativo, infiammazione, problemi nel metabolismo dei grassi e insulino-resistenza. Ma i dettagli molecolari precisi erano ancora un po’ un mistero.
Ed è qui che entriamo in gioco noi e il nostro studio su un modello animale.
Alla Scoperta degli RNA Circolari: Registi Nascosti della Cellula
Prima di addentrarci nei risultati, spendiamo due parole su questi circRNA. Non sono i soliti RNA messaggeri (mRNA) che portano le istruzioni per costruire proteine. No, questi sono speciali: sono molecole di RNA non codificante chiuse ad anello. Questa struttura circolare li rende incredibilmente stabili e resistenti alla degradazione rispetto agli RNA lineari. Sono come dei messaggeri segreti, longevi e specifici per certi tessuti, che stanno rivelando ruoli cruciali in tantissime malattie, dal diabete al cancro, passando per le patologie cardiovascolari e neurologiche.
Una delle loro funzioni più intriganti è quella di agire come “spugne” per i microRNA (miRNA). Immaginate i miRNA come dei piccoli interruttori che possono spegnere l’espressione di certi geni legandosi agli mRNA. I circRNA possono “catturare” questi miRNA, impedendo loro di fare il loro lavoro e, di conseguenza, influenzando quali geni vengono attivati o disattivati. Questo meccanismo è noto come rete ceRNA (competing endogenous RNA).
Considerando che i circRNA sono già stati collegati a diverse malattie del fegato, come la steatosi epatica non alcolica e persino il cancro al fegato, ci siamo chiesti: potrebbero essere coinvolti anche nel danno epatico indotto dall’AOS?
La Nostra Indagine sui Topolini: Cosa Abbiamo Fatto
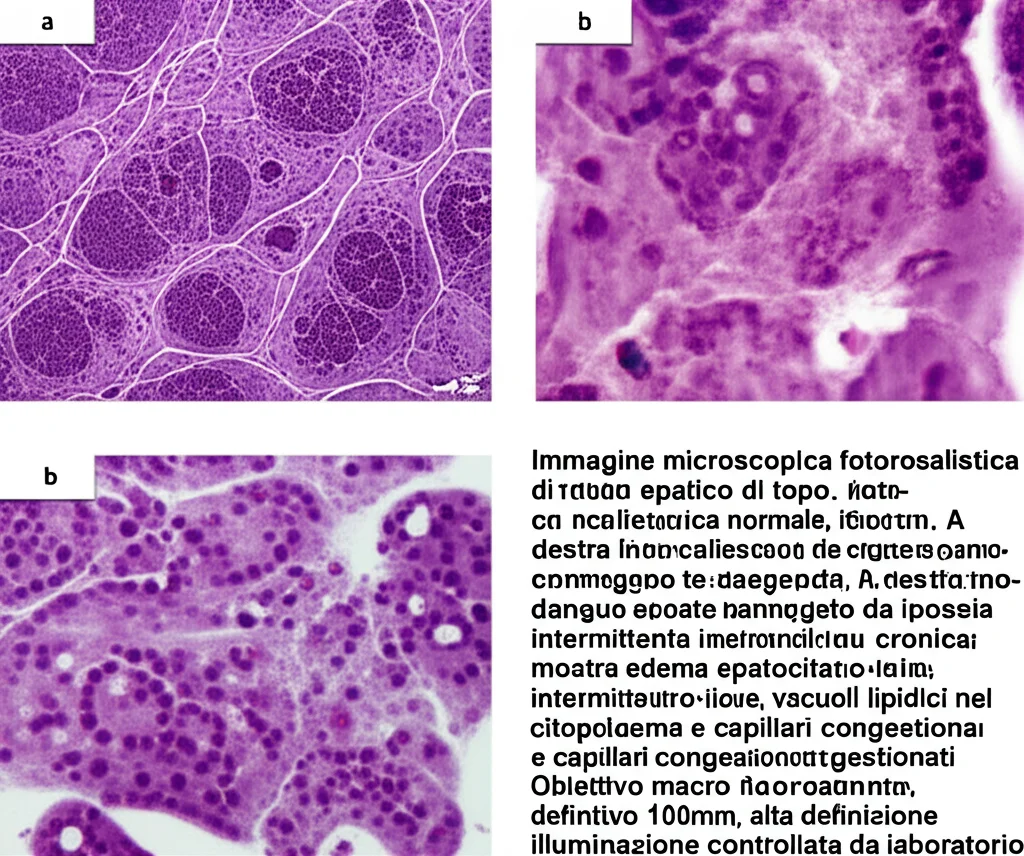
Per rispondere a questa domanda, abbiamo utilizzato un modello murino (topolini APOE, spesso usati per studiare disturbi metabolici ed epatici) e li abbiamo sottoposti a condizioni che simulano l’Ipossia Intermittente Cronica (IIC) tipica dell’AOS per 8 settimane. Un gruppo di controllo, invece, respirava aria normale.
Dopo questo periodo, abbiamo prelevato campioni di fegato da entrambi i gruppi e abbiamo eseguito un’analisi high-tech chiamata microarray di circRNA. Questo strumento ci permette di vedere quali circRNA sono presenti e in che quantità, confrontando i topolini “AOS” con quelli sani.
I risultati sono stati sorprendenti! Abbiamo identificato ben 259 circRNA espressi in modo differenziale tra i due gruppi: 86 erano aumentati (upregolati) nel gruppo IIC, mentre 173 erano diminuiti (downregolati). Questo ci ha subito detto che l’IIC stava chiaramente “rimescolando le carte” dell’espressione dei circRNA nel fegato.
Abbiamo visualizzato questi dati in vari modi: grafici a vulcano (che mostrano l’entità del cambiamento e la significatività statistica), mappe di calore (che raggruppano campioni e circRNA con profili simili) e abbiamo anche visto come questi circRNA fossero distribuiti sui diversi cromosomi dei topi (il cromosoma 2 sembrava particolarmente coinvolto).
Ovviamente, non ci siamo fidati ciecamente del microarray. Abbiamo selezionato otto circRNA candidati (quattro upregolati e quattro downregolati, scelti in base a vari criteri come l’entità del cambiamento e la significatività) e abbiamo verificato i loro livelli con un’altra tecnica, la qRT-PCR. I risultati hanno confermato quanto visto con il microarray, dandoci maggiore sicurezza.
Decifrare il Codice: La Rete ceRNA e le Funzioni Biologiche
Ma identificare i circRNA alterati è solo il primo passo. Volevamo capire *cosa* stessero facendo. Qui entra in gioco il concetto di rete ceRNA. Abbiamo usato software bioinformatici (basati su algoritmi come TargetScan e miRanda) per predire quali miRNA potessero essere “catturati” dai nostri circRNA differenzialmente espressi.
Ci siamo concentrati su tre circRNA particolarmente interessanti (mmu_circRNA_35781, 38959 e 38398) e abbiamo costruito una mappa complessa che collega questi circRNA ai miRNA che potenzialmente legano, e a loro volta, ai geni mRNA che questi miRNA controllano. Ne è venuta fuori una rete intricata con 3 circRNA, 37 miRNA e 70 mRNA! Questa rete suggerisce fortemente che i circRNA potrebbero influenzare il danno epatico da AOS proprio agendo come spugne per miRNA, modulando così l’espressione di geni chiave. Ad esempio, uno dei circRNA aumentati, mmu_circRNA_35781, è stato predetto legare diversi miRNA, potenzialmente “liberando” i geni bersaglio di questi miRNA.

Per capire ancora meglio le funzioni biologiche dietro questa rete, abbiamo eseguito altre analisi bioinformatiche: l’analisi GO (Gene Ontology) e l’analisi dei pathway KEGG.
L’analisi GO ci ha detto a quali processi biologici, componenti cellulari e funzioni molecolari fossero associati i geni bersaglio dei nostri circRNA. Sono emersi termini legati alla struttura intracellulare, al legame di ioni, al metabolismo e all’organizzazione cellulare.
L’analisi KEGG, invece, ci ha mostrato quali “vie di segnalazione” o percorsi metabolici fossero più coinvolti. Qui le cose si sono fatte ancora più interessanti: sono emersi pathway legati alla carcinogenesi chimica (soprattutto per i circRNA downregolati), alla malattia epatica alcolica, al metabolismo degli acidi grassi, al metabolismo del triptofano e, in modo significativo per i circRNA upregolati, al pathway del recettore NOD-like (NLR).
Quest’ultimo è particolarmente rilevante perché i recettori NLR sono noti per giocare un ruolo chiave nelle risposte immunitarie e infiammatorie, e la loro attivazione è stata collegata al danno d’organo indotto proprio dall’IIC. Quindi, è plausibile che alcuni circRNA aumentati nell’AOS contribuiscano al danno epatico attivando o modulando questa via infiammatoria.
Cosa Significa Tutto Questo e Dove Andiamo Ora?
In sintesi, il nostro studio ha fornito la prima “fotografia” dettagliata di come cambia il panorama dei circRNA nel fegato in un modello animale di danno indotto da AOS/IIC. Abbiamo identificato specifici circRNA che vengono deregolati e, attraverso analisi bioinformatiche, abbiamo proposto un meccanismo (la rete ceRNA) attraverso cui potrebbero contribuire al danno, influenzando vie biologiche cruciali come l’infiammazione (via NLR) e il metabolismo.
Questo apre scenari davvero promettenti! Questi circRNA potrebbero diventare:
- Nuovi biomarcatori: Immaginate di poter rilevare specifici circRNA (magari in campioni meno invasivi come sangue, esosomi o persino capelli, come suggeriamo per ricerche future) per diagnosticare precocemente o monitorare la progressione del danno epatico nei pazienti con AOS.
- Nuovi bersagli terapeutici: Se riusciamo a capire esattamente come funzionano i circRNA “cattivi”, potremmo sviluppare terapie mirate per bloccarli o per ripristinare i livelli di quelli “buoni”, offrendo un approccio innovativo per trattare le complicanze epatiche dell’AOS.

Certo, siamo onesti, il nostro studio ha delle limitazioni. Abbiamo usato un numero limitato di animali, e solo maschi di un ceppo specifico (APOE). Inoltre, molte delle nostre scoperte sui meccanismi sono basate su predizioni bioinformatiche e necessitano di conferme sperimentali più dirette (come saggi specifici per validare le interazioni circRNA-miRNA). E, naturalmente, un modello animale, per quanto utile, non è mai perfettamente identico alla condizione umana.
Nonostante ciò, crediamo fermamente che questo lavoro getti basi solide e apra una nuova, eccitante strada di ricerca. Abbiamo acceso un faro sul ruolo potenziale, e finora poco esplorato, degli RNA circolari nel complesso legame tra apnea ostruttiva del sonno e salute del fegato. Il prossimo passo sarà approfondire i meccanismi specifici di questi affascinanti regolatori molecolari. Restate sintonizzati!
Fonte: Springer