Risonanza Magnetica e AI: Sveliamo i Segreti del Carcinoma Epatocellulare con SHAP
Ciao a tutti! Oggi voglio parlarvi di qualcosa che mi affascina tantissimo: come le tecnologie più avanzate, come la risonanza magnetica (MRI) e l’intelligenza artificiale (AI), ci stanno aiutando a capire meglio e a combattere nemici ostici come certi tipi di cancro al fegato. Nello specifico, mi sono imbattuto in uno studio super interessante che usa una combinazione di queste tecniche per scovare una forma particolarmente aggressiva di carcinoma epatocellulare (HCC), quella con fenotipo colangiocitario. E la parte più bella? Lo fanno usando un’AI “interpretabile”, che ci spiega *perché* arriva a certe conclusioni. Andiamo a vedere di cosa si tratta!
Il Problema: Un Cancro al Fegato Particolarmente Aggressivo
Il carcinoma epatocellulare (HCC) è già di per sé una brutta bestia, uno dei tumori più comuni al mondo. Ma non tutti gli HCC sono uguali. Esiste una variante, chiamata HCC con fenotipo colangiocitario (perché esprime marcatori tipici delle cellule dei dotti biliari, come la citocheratina CK19 o CK7), che è ancora più subdola e invasiva. Questo tipo di tumore tende a dare più metastasi ai linfonodi, a invadere più facilmente i vasi sanguigni e, in generale, è associato a una prognosi peggiore rispetto all’HCC “classico”.
Capite bene che riuscire a identificare *prima* dell’intervento chirurgico se un paziente ha questo specifico sottotipo di HCC sarebbe un vantaggio enorme. Permetterebbe ai medici di scegliere la strategia chirurgica migliore, pianificare eventuali terapie aggiuntive e valutare meglio il rischio di recidiva. Il problema è che l’unico modo sicuro per saperlo oggi è la biopsia, che però è invasiva (con i suoi rischi) e non sempre affidabile al 100%. A causa dell’eterogeneità del tumore, un piccolo campione prelevato potrebbe non essere rappresentativo dell’intera massa tumorale, sottostimando o sovrastimando la presenza di questi marcatori. C’era bisogno di un metodo non invasivo.
La Soluzione Tecnologica: Risonanza Magnetica Potenziata e Mappe T1
Qui entra in gioco la tecnologia. La risonanza magnetica potenziata con acido gadoxetico è uno strumento potentissimo. L’acido gadoxetico è un mezzo di contrasto particolare perché viene assorbito specificamente dalle cellule epatiche funzionanti. Questo ci permette di vedere non solo l’anatomia del fegato e del tumore, ma anche di avere informazioni sulla funzionalità delle cellule.
Accanto a questo, lo studio ha utilizzato una tecnica chiamata T1 mapping. Senza entrare troppo nel tecnico, il T1 mapping è un metodo quantitativo che misura il tempo di rilassamento T1 dei tessuti. Questo valore T1 è una caratteristica intrinseca del tessuto e non dipende troppo dai parametri della macchina MRI. Combinando il T1 mapping con l’iniezione di acido gadoxetico, possiamo misurare con precisione come e quanto il mezzo di contrasto viene assorbito dalle cellule, ottenendo così informazioni preziose sulle caratteristiche biologiche dell’HCC. Già in passato, questa combinazione si era dimostrata utile per valutare la differenziazione del tumore o il rischio di invasione microvascolare, ma nessuno l’aveva ancora usata specificamente per identificare l’HCC con fenotipo colangiocitario.
L’Intelligenza Artificiale Interpretabile: XGBoost e SHAP
Avere tanti dati dalla risonanza magnetica è fantastico, ma come interpretarli al meglio? Ecco che subentra il machine learning (ML). I ricercatori hanno raccolto dati clinici (come età, sesso, valori del sangue) e dati derivati dalle immagini MRI (sia qualitativi, valutati dai radiologi, sia quantitativi, come le mappe T1) da un gruppo di pazienti con HCC confermato istologicamente.
Hanno poi “allenato” diversi algoritmi di machine learning per vedere quale fosse il migliore nel predire la presenza del fenotipo colangiocitario. Tra i modelli testati (Random Forest, K-Nearest Neighbors, Support Vector Machine, Logistic Regression e eXtreme Gradient Boosting – XGBoost), quest’ultimo, XGBoost, è risultato il più performante.
Ma qui arriva la parte che trovo davvero rivoluzionaria. Uno dei grossi limiti del machine learning in medicina è il problema della “scatola nera” (black-box): l’algoritmo ti dà una risposta, magari accuratissima, ma non ti spiega come ci è arrivato. Questo rende difficile per i medici fidarsi ciecamente e integrare questi strumenti nella pratica clinica. Per superare questo ostacolo, lo studio ha utilizzato SHAP (SHapley Additive exPlanations). SHAP è una tecnica basata sulla teoria dei giochi che permette di “aprire” la scatola nera e capire il contributo di ciascun singolo dato (ogni feature clinica o radiologica) alla previsione finale del modello per ogni singolo paziente. In pratica, ci dice *perché* l’AI pensa che quel paziente abbia o meno l’HCC con fenotipo colangiocitario. Fantastico, no?

I Fattori Chiave Svelati da SHAP
Grazie all’analisi con SHAP, lo studio ha identificato le quattro caratteristiche clinico-radiologiche più importanti per la predizione:
- Rapporto piastrine/linfociti (PLR): Un indicatore legato all’infiammazione, già noto per essere correlato a prognosi peggiori in vari tumori. Un PLR più alto sembra associato a questo fenotipo.
- Capsula tumorale: La presenza di una capsula completa intorno al tumore è generalmente un segno positivo. L’assenza o l’incompletezza della capsula, invece, è risultata associata all’HCC con fenotipo colangiocitario, suggerendo una maggiore aggressività e tendenza a invadere i tessuti circostanti.
- Segno a bersaglio nella fase epatobiliare (HBP): Un pattern specifico visibile nelle immagini MRI dopo l’iniezione del contrasto. Questo segno era più comune nei tumori con fenotipo colangiocitario, forse a causa della presenza di tessuto fibroso all’interno del tumore che trattiene il contrasto.
- Tempo di rilassamento T1 a 20 minuti (T1rt-20 min): Questo è risultato il fattore più importante secondo l’analisi SHAP! Un valore di T1rt-20 min superiore a una certa soglia (circa 797 ms) era fortemente indicativo della presenza del fenotipo colangiocitario. L’ipotesi è che questi tumori, essendo più densi e aggressivi, sostituiscano le cellule epatiche normali, riducendo l’assorbimento del mezzo di contrasto e mantenendo quindi un tempo T1 più lungo dopo 20 minuti.
Questa scoperta sul T1rt-20 min è particolarmente interessante perché evidenzia il valore aggiunto del T1 mapping quantitativo rispetto alle valutazioni MRI tradizionali.
Validazione e Implicazioni Prognostiche
Un modello predittivo è utile solo se funziona bene anche su nuovi pazienti. I ricercatori hanno fatto le cose per bene, validando il modello XGBoost non solo su una parte dei dati iniziali (validazione interna), ma anche su dati provenienti da un’altra istituzione (validazione esterna) e su un gruppo di pazienti raccolti prospetticamente (validazione prospettica). I risultati sono stati consistenti, con buone performance (AUC tra 0.776 e 0.835) in tutti i gruppi.
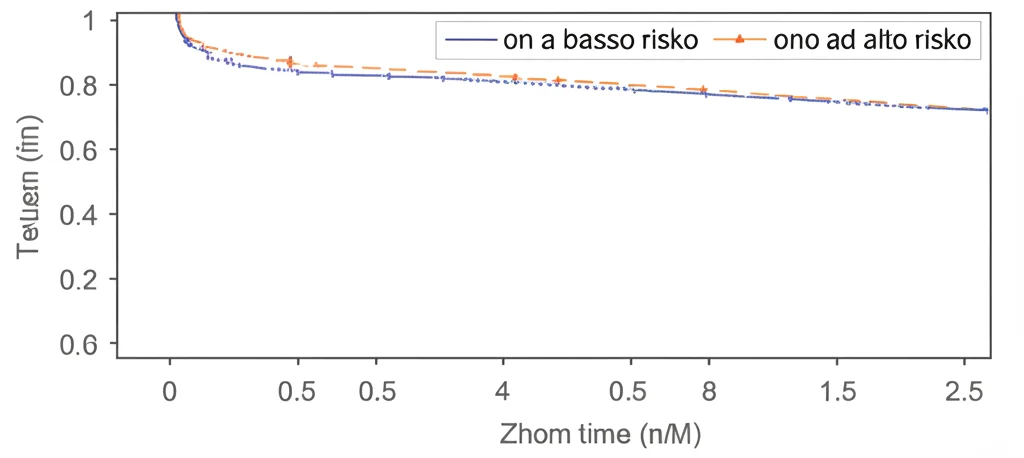
Ma non è finita qui. Hanno anche verificato se questo modello potesse avere un valore prognostico. Analizzando la sopravvivenza libera da recidiva (RFS) dei pazienti, hanno confermato che quelli con HCC a fenotipo colangiocitario avevano effettivamente una RFS peggiore. E, cosa importante, il modello XGBoost è stato in grado di stratificare i pazienti in gruppi a basso e alto rischio di recidiva, con differenze statisticamente significative nella sopravvivenza. Questo significa che il modello non solo aiuta nella diagnosi, ma potrebbe anche dare indicazioni utili sulla prognosi del paziente.
Cosa Significa per il Futuro?
Questo studio, secondo me, è un esempio brillante di come la collaborazione tra radiologia avanzata e intelligenza artificiale interpretabile possa portare a progressi concreti in medicina. L’uso di T1 mapping offre un valore quantitativo importante, mentre SHAP rende l’AI uno strumento trasparente e affidabile per i medici.
Immaginate un futuro in cui, grazie a una semplice risonanza magnetica analizzata da un’AI come questa, si possa ottenere una diagnosi preoperatoria molto più accurata di questi tumori aggressivi, personalizzare il trattamento e dare ai pazienti informazioni più precise sul loro percorso.
Limiti e Prossimi Passi
Ovviamente, come ogni ricerca, anche questa ha i suoi limiti. La dimensione del campione non era enorme, e lo studio ha incluso solo pazienti operabili, il che potrebbe introdurre un bias di selezione. Inoltre, si è valutata solo l’espressione di CK19 e non altri marcatori potenzialmente rilevanti. Saranno necessari studi futuri su campioni più ampi e diversificati per confermare questi risultati e affinare ulteriormente il modello. L’analisi delle immagini dipende ancora dall’esperienza del radiologo, anche se le misure quantitative come il T1 mapping aiutano a standardizzare. Forse in futuro, tecniche di radiomica potrebbero ulteriormente automatizzare l’analisi.
In Conclusione
Nonostante i limiti, trovo che questo lavoro apra strade davvero promettenti. Abbiamo sviluppato e validato un modello di machine learning basato su MRI potenziata con acido gadoxetico e T1 mapping che sembra identificare efficacemente l’HCC con fenotipo colangiocitario. Il T1 mapping si è rivelato un elemento chiave, e l’uso di SHAP per rendere le predizioni personalizzate e interpretabili è un passo fondamentale per portare l’AI dal laboratorio alla pratica clinica. Questo approccio offre spunti preziosi per supportare le decisioni dei medici e migliorare la gestione dei pazienti con questa difficile forma di cancro al fegato. Non vedo l’ora di vedere come si evolverà questo campo!
Fonte: Springer